Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.21 no.1 Santa Marta Jan./Dec. 1992
DESARROLLO EMBRIONARIO DEL CALAMAR TROPICAL SEPIOTEUTHIS SEPIOIDEA (BLAINVILLE) (CEPHALOPODA: LOLIGINIDAE)
Sylvia Fagundez, Raúl Ramírez y Germán Robaina
FUNDACIENCIA, Estación de Investigaciones Marinas L. D. Bauperthuy, A. Postal88014, Caracas 1084-A, Venezuela.
RESUMEN
Se presenta una descripción de las principales características, estadios y procesos que ocurren durante el desarrollo embrionario del calamar tropical Sepioteuthis sepioidea a partir de masas ovígeras localizadas en el medio ambiente natural, incubadas en condiciones de laboratorio (salinidad 35 ‰, temperatura 25°C y fotoperíodo de 12 Hr). Se encontró que el desarrollo embrionario de esta especie es similar al descrito para Loligo pealei y Sepia officinalis, con una duración aproximada de 40 días bajo las condiciones de incubación empleadas. Los procesos de blastulación y gastrulación ocupan un 25% del tiempo total de desarrollo de la especie (entre 10 y 12 días) y la organogénesis un 75% (entre 28 y 30 días).
ABSTRACT
A description of the main characteristic stages and processes of embrionic development of Sepioteuthis sepioidea egg clusters collected in their natural enviroment is presented. Eggs were incubated in laboratory conditions (salinity 35 ‰, temperature 25°C, photoperiod 12 hrs.). Embrionic development of this species is similar to that described for Loligo pealei and Sepia officinalis with an approximate duration of 40 days in laboratory. Blastulation and gastrulation processes of the species consumed 25% of the total developing time (10 to 12 days) and organogenesis the last 75% (28 to 30 days).
INTRODUCCIÓN
El desarrollo embrionario en los cefalópodos es considerado único entre los moluscos, ya que se caracteriza por presentar una segmentación incompleta del huevo telolecítico, formando un blastodisco y no la segmentación espiral característica de los moluscos. Además, el estadio de larva trocófora o veliger no existe, ya que el desarrollo en los cefalópodos es directo (Boletzky, 1974). Al igual que los huevos telolecíticos de aves y reptiles, en los cefalópodos la segmentación es meroblástica y termina en la formación de un casquete o disco germinal de células en el polo animal donde luego se desarrolla el embrión. El borde del disco crece en torno a la yema y forma un saco vitelino que es absorbido gradualmente durante el desarrollo.
Sepioteuthis sepioidea (Blainville, 1823) es la especie de cefalópodo decápodo que mayor atención ha recibido en Venezuela desde el punto de vista científico, por poseer, entre otros, gran interés como fuente de material biológico para el desarrollo de la neurofisiología (Villegas, 1972 y 1984), fisiología (Ramírez, 1985), estudios biológicos, ecológicos y de cultivo (Robaina, 1.983; Robaina et al. 1983; Voglar y Robaina, 1984; Robaina y Voglar, 1986). Sin embargo hasta la fecha las principales características de los procesos que conforman el desarrollo embrionario de la especie no habían sido descritas, por lo que el presente trabajo ofrece una descripción de su desarrollo embrionario, las principales variaciones encontradas a lo largo de los distintos estadios que conforman este proceso y las relaciones existentes entre el grado de desarrollo y los principales elementos morfométricos del embrión y/o corión como elemento complementario de la descripción.
MATERIALES Y MÉTODOS
Masas ovígeras de S. sepioidea fueron colectadas en aguas costeras de la isla de Cubagua y de la Bahía de Mochima, Venezuela, mediante la utilización de colectores artificiales construidos con tejas de asbesto y bloques de cemento, colocados a profundidades comprendidas entre 1 y 20 metros.
Una vez desprendidas manualmente de los colectores y colocadas en recipientes con agua marina hiperoxigenada, las masas ovígeras fueron trasladadas al laboratorio, en donde se seleccionaron aquellas que presentaban las mejores condiciones y el más bajo grado de desarrollo. Estas se incubaron en tanques circulares de 1800 1 de capacidad, provistos de un sistema de circulación continua de agua de mar, con 25-27 °C de temperatura, 37- 38 ‰ de salinidad y un fotoperíodo de 12 horas, suspendiéndolas de una malla plástica flotante a fin de simular su posición natural.
Para poder determinar y describir los principales estadios del proceso de desarrollo embrionario de la especie, una muestra de diez huevos fué observada diariamente y fotografiada con la ayuda de un microscopio binocular, tomando nota de los principales cambios observados y comparándolos con los descritos por Arnold (1965). Cada dos días, a una sub-muestra de los embriones sometidos a observación (una vez extraídos de su envoltura coriónica), se le determinó la longitud del manto (LM), longitud del saco vitelino externo (LSV), longitud de la cabeza (LC) y diámetro máximo del corión (DC) utilizando un micrómetro adaptado al microscopio.
En base a las observaciones realizadas se describen los principales procesos que tienen lugar en el desarrollo embrionario de la especie y se presenta un análisis de la utilidad del diámetro del corión, el grado de cobertura del blastodermo, la longitud del manto y la longitud de la cabeza de los embriones como elementos indicadores del grado de desarrollo embrionario de la especie.
RESULTADOS
Los huevos del calamar Sepioteuthis sepioidea se encuentran envueltos por varias capas de una sustancia gelatinosa de color blanquecino, claramente identificables. Esta gelatina semitransparente envuelve por lo general de dos a cuatro huevos formando una estructura en forma de "dedo" cuyo diámetro varía a lo largo del desarrollo (Fig. 1). Estas estructuras protectoras están unidas unas a otras mediante una estructura de adhesión de la misma naturaleza que la envoltura, formando masas ovígeras con un número variable de "dedos" y huevos. La envoltura o corión de cada huevo presenta un diámetro inicial, al momento del desove, de 8 mm, y llega a alcanzar 16 - 18 mm aproximadamente antes de que ocurra la eclosión del embrión, adquiriendo progresivamente una forma más o menos esférica.
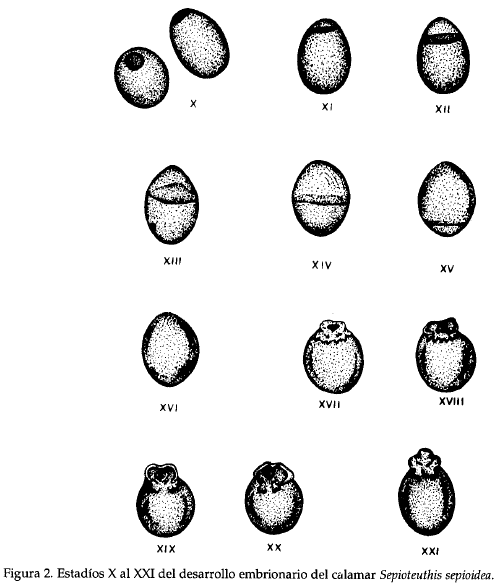
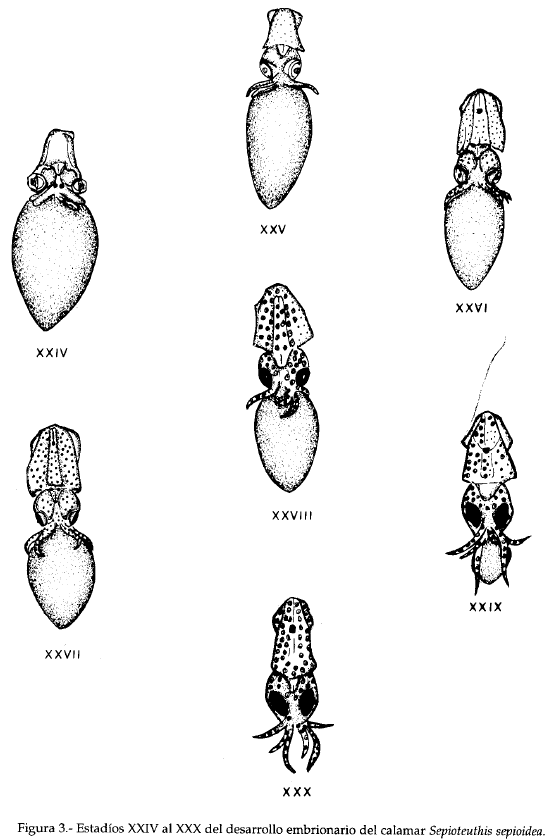
El desarrollo embrionario de S. sepioidea comprende 30 estadios, de los cuales los 16 primeros (I-XVI) abarcan los procesos de blastulación y gastrulación, y los restantes (XVII-XXX) los ocupa el proceso de organogénesis.
La blastulación comienza con la formación del blastodisco (estadio I), seguida por una serie de divisiones celulares, hasta llegar a conformar un blastodermo de 64 células (estadio IX) que siempre mantiene un patrón bilateral. Una vez formado el blastodermo multiestratificado, empieza el proceso de gastrulación (estadio X), durante el cual el blastodermo comienza a expandirse y a cubrir el resto del huevo (7% en el estadio XI, 17% en el estadio XII, 35% en el estadio XIII, 65% en el estadio XIV, 76% en el estadio XV y 82% en el estadio XVI), hasta terminar cubriéndolo totalmente en el estadio XVII (Fig.2) y lograr su diferenciación en tres capas germinales: endodermo, mesodermo y ectodermo (también llamado epitelio interior del huevo). Los procesos descritos hasta el momento ocupan sólo un 25% del tiempo total del desarrollo embrionario y finalizan 10 días después de realizada la fecundación, período en el cual el corión no sufre cambios aparentes, y es sólo hacia el día 13 cuando éste comienza a "hincharse" por la entrada de agua del medio hacia el interior del huevo.
La organogénesis de S. sepioidea tiene una duración de 28 a 30 días aproximadamente, representando el 75% del tiempo total del desarrollo embrionario de la especie. Comienza en el estadio XVII cuando más del 83% de la superficie del huevo está recubierta por el sinsitio del vitelo y el ectodermo extraembrionario, y empieza a notarse el primodio del manto y la glándula de la concha. A partir de este momento (día 11 aproximadamente) y hasta la finalización del proceso, se observa un incremento progresivo de la longitud del manto del ejemplar con respecto al tiempo.
En el estadio XVIII, el cuerpo del embrión es ligeramente visible: empiezan a formarse los primeros vestigios de la boca, sifón, branquias y brazos y el borde del manto es más relevante. En el estadio XIX el embrión posee una longitud del cuerpo de 1.27 + 0.09 mm (19.6%) y el saco vitelino5.21 ± 0.17 mm (80.4%). Son identificables los esbozamientos de los ojos, que progresivamente se irán definiendo hasta el estadio XX, donde logran diferenciarse uno del otro.
En los estadios XXI y XXII, las vesículas de los ojos están completamente cerradas y son prominentes; el sifón se fusiona hasta la parte media, aparecen los estatocistos, el manto comienza a desarrollarse hacia abajo y en su parte posterior se evidencian las aletas. La diferenciación del saco vitelino extraembrionario ocurre por una constricción en el estadio XXIII, en el que se presentan los esbozos del cristalino y las ventosas de los brazos; el manto cubre la mitad de las branquias, el sifón está completamente formado, el embrión presenta los primeros movimientos ondulantes en la superficie del saco vitelino. En este estadio el manto posee una longitud de 1.02 ± 0.29 mm (14%), el saco vitelino alcanza los 5.15 + 0.09 mm (1.3%) y la cabeza unos 1.06 ± 0.21 mm (14.6%).
La actividad circulatoria comienza en el estadio XXIV generando lentas pulsaciones del saco vitelino. La longitud del manto alcanza 1.15 ± 0.43 mm (15.7%), la cabeza 1.03 ± 0.09 mm (14%) y el saco vitelino 5.15 ± 0.43 mm (70.3%).
En el estadio XXV el manto llega a cubrir completamente las branquias, las aletas están diferenciadas, los filamentos branquiales se observan Individuales y el cristalino se nota esférico. La longitud del manto alcanza 1.99 + 0.09 mm (24.8%), la cabeza 1.52 ± 0.09 mm (19%) y el saco vitelino 5.51 ± 0.26 mm.
La pigmentación aparece por primera vez en el estadio XXVI, cuando la retina muestra una coloración anaranjada y aparecen los cromotóforos en la parte ventral del manto. Esta pigmentación se incrementa en el estadio XXVII y XXVIII cuando los cromatóforos cubren la cabeza, brazos, sifón y parte dorsal del manto. En el estadio XXVII aparece la cornea secundaria cubriendo solo la mitad de la retina y el órgano de Hoyle u órgano de eclosión. La longitud del manto los 4.30 + 0.43 mm (36.2), la cabeza 1.88 ± 0.26 mm (15.8%) y el saco vitelino 5.69 ± 0.17 mm (48%). A partir del momento en el cual el embrión alcanza los 4 mm de longitud del manto (estadio XXVII) el tamaño del saco vitelino comienza a disminuir progresivamente en relación inversa a la longitud del animal hasta que es finalmente consumido en su totalidad cuando el manto alcanza los 7 mm de longitud (estadio XXX).
En el estadio XXVIII, el manto alcanza los 5.39 ± 0.17 mm (23%) y el saco vitelino 4.36 ± 0.17 mm (34.4), se completa la formación del sifón, el embrión se encuentra completamente formado, el saco vitelino se ha reducido (2.61 + 0.94 mm) (20,3%) la cabeza alcanza los 3.27 + 0.17 mm (25.5%), y el manto los 6.97 ± 0.43 mm (54.2%).
En el estadio XXX se ha consumido totalmente el saco vitelino y se produce la eclosión de los juveniles al ponerse en contacto el órgano de Hoyle con la superficie interna del corión (Fig. 3), pudiendo también ocurrir en los estadios XXVII y XXIX cuando los huevos son manipulados en exceso, siendo frecuente que los ejemplares recién eclosionados aún no hayan digerido la totalidad de sus reservas vitelinas externas.
La relación encontrada entre la longitud del manto del embrión y el diámetro del corión (DC) fue altamente significativa (F = 471.4 R2 = 0.952 r = 0.975) respondiendo a la ecuación de tipo exponencial:
DC= 8.588 e0.100LM
La relación existente entre el total de días trascurridos y la cobertura del blastodermo (CB) del huevo del calamar, tuvo valores de F de 47.9; R2 = 0.857 y R = 0.925 y respondió a la ecuación:
CB= 0.002 días3.430
La relación existente entre el número de días transcurridos y la longitud del manto del embrión, con valores de F = 317.5; R2 = 0.967 y R = 0.983, se representó por la ecuación:
LM = 0.011 días1.817
La relación existente entre la duración del desarrollo embrionario y el diámetro del corión del embrión (DC), con un valor de F= 46.2; R2 = 0.731 y R= 0.855, se representa por la ecuación:
DC = 4.988 días0.300
Los datos obtenidos para la envoltura del corión, longitud del manto y grado de cobertura del blastodermo a lo largo de los diferentes días de observación se presentan de manera gráfica en la Fig. 4; la Fig. 5 muestra la relación existente entre la longitud del ejemplar y el diámetro del corión del huevo.
DISCUSIÓN
El huevo del calamar S. sepioidea a medida que avanza en su desarrollo, va aumentando de diámetro y adquiriendo una forma más o menos esférica como consecuencia al aumento de volumen de agua en el espacio corión-embrión producido por la mayor permeabilidad de la envoltura protectora al agua de mar, proceso que ha sido descrito para otros cefalópodos por Arnold (1965), Arnold et al (1972), Boletzky y Hanlon (1983) y Boletzky (1974).
Al igual que en otros decápodos, los huevos de S. sepioidea se encuentran protegidos formando racimos en forma de dedos, alcanzando esta especie a colocar hasta 350 huevos por racimo. Su desarrollo embrionario, al igual que de los descritos para Loligo pealei y Sepia officinalis (Arnold, 1965; Lemaire, 1970) comprende 30 estadios fácilmente diferenciables y reagrupables en tres procesos básicos como lo son blastulación, la gastrulación y la organogénesis. La blastulación comprende entre los estadios I y X; la gastrulación, los estadios comprendidos entre el XVII y XXX y la organogénesis entre los estadios XVII y XXX.
Los procesos que suceden a lo largo de los primeros XVII estadios (blastulación y gastrulación) de S. sepioidea son iguales a los descritos para L. pealei y S. officinalis, ocupando un 25% del total de desarrollo embrionario; y se caracterizan por una marcada tendencia (99% aproximadamente) a comenzar, al igual que ocurre en los cefalópodos octópodos, por la porción apical del huevo (polo animal).
La organogénesis representa un 75% de la duración total del desarrollo embrionario del L. pealei (10 -11 días a 20 - 21 °C) e inferior al de S. officinalis (38 días a 20°). Sin embargo los cambios que caracterizan a este proceso son comparables con los descritos por Arnold (1965) para L. pealei en su gran mayoría, pero no con los descritos por Lemaire (1970) para S. officinalis, donde la formación de los diferentes órganos y estructuras difieren sustancialmente. No obstante cabe destacar que tanto en S. sepioidea como S. officinalis los porcentajes de talla son comparables entre uno y otro, características que guardan estrecha relación con la duración del desarrollo embrionario de las especies y la talla de los iuveniles recién eclosionados, ya que a diferencia de L. pealei estas especies producen juveniles que al nacer poseen una talla significativamente mayor, en concordancia con las diferentes estrategias reproductivas que ponen en juego estas especies.
La alta relación encontrada entre las distintas características morfométricas y la duración del desarrollo embrionario de Sepioteuthis sepioidea permiten la utilización de la longitud del manto, el grado de cobertura del blastodermo y la longitud de la cabeza del embrión como elementos indicadores del grado de desarrollo embrionario de la especie facilitando tanto su reconocimiento como las experiencias de laboratorio.
BIBLIOGRAFÍA
1 Arnold, J. M. 1965. Normal embryonic stages of the squid, Loligo pealii (Lesueur). Biol. Bull., 128: 24-32. [ Links ]
2 Arnold, J. M.; C. T. Singley y L. D. William -Arnold. 1972. Embryonic development and post-hatching survival of the sepiolid squid Euprimna scolopes under laboratory conditions. The Veliger, 14(4): 361 -364. [ Links ]
3 Boletzky, S. 1974. The larvae of Cephalopoda a review. Thal. Jugoslavica, 10-1/2): 45-76. [ Links ]
4 Boletzky, S. y R. T. Hanlon. 1983. A review of the laboratory maintenance, rearing and culture of cephalopod molluscs. Mem. Nat. Mus. Victoria, 44: 147-187. [ Links ]
5 Lemaire, J. 1970. Tablede developpement embryonnaire de Sepia officinalis L. (Mollusque, Cephalopode). Bull. Soc. Zool. Fr., 95: 773-782. [ Links ]
6 Ramírez, R. 1985. Parámetros hemagasodinámicos y electrolíticos de la hemolinfa del calamar tropical Sepioteutis sepioidea (Blainville, 1823). Tesis Grado, Univ. Oriente, Núcleo Sucre, Venezuela, 56p. [ Links ]
7 Robaina, G. 1983. Algunos aspectos sobre el cultivo de los moluscos cefalópodos octópodos. Rev. Latinoamer. Acuicult., 16: 1-42. [ Links ]
8 Robaina, G. y J. Voglar. 1986. Maduración sexual de las hembras de Sepioteuthis sepioidea (Blainville, 1823) (Cephalopoda,Loliginidae) en las costas venezolanas. Invest. Pesq., 50 (1): 57-68. [ Links ]
9 Robaina, G.; J. L. Lugo y J. Voglar. 1983. Los cefalópodos y la acuicultura de repoblación. Acta Cient. Venez., 34(1): 2. [ Links ]
10 Villegas, J. 1972. Axon-Schawann cell relationship. Curr. Topic Membr. Transp., 22: 547-571. [ Links ]
11 Voglar, J. y G. Robaina. 1984. Maduración sexual de los machos del calamar Seioteuthis sepioidea (Blainville, 1823) en las costas del nororiente venezolano. Contrib. Cient. Centro Invest. Cient. UDO, 16: 35 p. [ Links ]