Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO  Similares em Google
Similares em Google
Compartilhar
Revista Colombiana de Cardiología
versão impressa ISSN 0120-5633
Rev. Col. Cardiol. v.12 n.2 Bogota ago. 2005
Disección de aorta. Aspectos básicos y manejo endovascular
Nicolás I. Jaramillo, MD.(1); Carlos L. Alviar, MD.(2)
(1) Clínica Las Américas, Medellín, Colombia.
(2) CEMDE- Centro de medicina y ejercicio y rehabilitación cardiaca, Medellín, Colombia.
Correspondencia: Nicolás I. Jaramillo Gómez, MD.; Clínica Las Américas, Calle 33 No. 70ª-185, teléfono: 4112421, Medellín, Colombia.
El tratamiento de la patología aórtica torácica se complica por la asociación con una alta mortalidad en la reparación quirúrgica, y al mismo tiempo fragilidad y gran comorbilidad en los adultos de edad avanzada. En la búsqueda por reducir la incidencia de resultados negativos, en la década pasada se introdujo la técnica de intervención por la vía de la mínima invasión, con la colocación de dispositivos del tipo stent vía endovascular.
La técnica, originalmente descrita por Parodi e inicialmente diseñada para uso en la corrección de aneurismas de aorta abdominal, ha sido adoptada para el uso en la patología aórtica torácica.
El mejoramiento en el entendimiento de la fisiopatología y la historia natural de la enfermedad de la aorta torácica y el análisis de los resultados, han facilitado la toma de decisiones en cuanto al tratamiento en términos del tiempo de la intervención apropiada.
El tratamiento de la disección de la aorta torácica con el uso de stent endovascular, es uno de los más recientes avances en el tratamiento y hoy recibe una atención especial, al punto que es una alternativa menos invasiva; incluso la tecnología está apenas en sus primeras etapas y en los últimos años se han mejorado significativamente el diseño y el sistema de liberación de estos dispositivos endovasculares conocidos como stent-grafts.
Estas prótesis se utilizan de forma creciente en el tratamiento de aneurismas, disecciones, rupturas traumáticas, úlceras penetradas gigantes y hematomas intramurales de la aorta torácica descendente, con buenos resultados tanto tempranos como a mediano plazo.
La poca frecuencia, la alta complejidad y la severidad de la patología, y al mismo tiempo el alto riesgo teórico de las complicaciones que se pueden generar, deben mantener cauto al operador, especialmente cuando esta técnica se aplica en pacientes jóvenes.
De manera conceptual la solución por la vía endoluminal en las fases agudas, probablemente llegue a ser la terapia preferida, aunque la técnica todavía está en proceso de refinamiento.
A nivel mundial la experiencia viene en crecimiento y hoy se entienden mejor las indicaciones y las limitaciones de esta terapia innovadora.
En este artículo se hace una revisión general sobre el diagnóstico clínico y el manejo de la disección aórtica y sus variantes: el hematoma intramural y la úlcera aórtica aterosclerótica.
Palabras clave: disección de aorta, aneurisma aórtico, hematoma intramural, úlcera penetrada aórtica, stent-grafts, dispositivo endovascular, tratamiento percutáneo, tratamiento quirúrgico.
Treatment of thoracic aortic pathology is complicated by the morbidity associated to the surgical procedure and to the frailty of an elderly and difficult population. Surgical operation in this kind of population frequently bears a significant incidence of death and long term disability. In an effort to reduce the incidence of negative outcomes, minimally invasive techniques in the form of endovascular stenting have been introduced during the past decade. The technology, originally described by Parodi, and initially designed for its use in abdominal aortic aneurysms, has been adapted for the treatment of thoracic aortic aneurysms.
Furthermore, an improved understanding of the pathophysiology and the natural history of thoracic aortic disease as well as the analysis of the outcomes has facilitated our treatment decisions in terms of the timing for an appropriate intervention.
Treatment of thoracic aortic dissection using endovascular stent is one of the more recent advances in this condition and is receiving increasing attention as it is a less invasive alternative to an open surgical repair. Although this technology is still innovative, significant improvements have been made lately in the design and deployment of the endovascular stent-grafts. These prostheses have been increasingly used to treat aneurysms, dissections and traumatic ruptures, as well as giant penetrating ulcers and intramural hematomas of the descending thoracic aorta with good early and mid-term outcomes.
The rareness, complexity and severity of the pathology and the theoretically high risk of complications should render the surgeon extremely cautious especially with young patients.
Conceptually, the endoluminal treatment in the acute phase seems to be the solution and will probably become a preferred therapy while technical refinement is under way.
Worldwide experience is growing and with this a better understanding of the indications and limitations of this innovative therapy will be elucidated.
The clinical, diagnostic and management perspectives on aortic dissection and its variants, aortic intramural hematoma and atherosclerotic aortic ulcer, are reviewed.
Key words: aortic dissection, aortic aneurysm, intramural hematoma, aortic penetrating ulcer, stent-grafts, endovascular device, percutaneous treatment, surgical treatment.
Introducción
La aterosclerosis como enfermedad sistémica tiene manifestaciones en los múltiples lechos vasculares. Los eventos clínicos resultan de la progresión de la lesión aterosclerótica a la cual se sobreimponen fenómenos trombóticos aunados a los procesos dinámicos que incluyen ulceración, ruptura de la placa, hemorragia intramural, fragmentación e incluso embolismo.
La enfermedad de la aorta relacionada con aterosclerosis incluye:
- Enfermedad oclusiva.
- Aneurisma.
- Disección.
- Hematoma intramural.
- Úlcera penetrada de aorta.
La disección de aorta, especialmente en la situación aguda, es una entidad poco común pero catastrófica cuando se presenta. Estadísticas de Estados Unidos muestran una incidencia de al menos 2.000 casos por año (1).
La frecuencia se encuentra establecida entre 10 y 20 casos por millón/año (2).
Cuando la disección se convierte en subaguda o crónica, presenta una mortalidad espontánea a 30 días de aproximadamente 50%, y una mortalidad anual del 60% al 90%. Alrededor del 60% son tipo A de acuerdo con la clasificación de Stanford, con localización de la entrada de la disección en la aorta ascendente, mientras que cerca del 40% son tipo B, envolviendo exclusivamente la aorta torácica descendente.
Según el sitio anatómico de la ruptura de la íntima, 65% ocurre en la aorta ascendente, 20% en la aorta descendente, 10% en el arco aórtico y 5% en la aorta abdominal (3).
Una disección puede generarse a partir de una ruptura de la vasa vasorum en la media de la aorta (formación de un hematoma intramural). Esta hemorragia local se rompe secundariamente a través de la capa intimal, creando así la ruptura intimal y la disección aórtica. Este tipo de disección, que con el avance en las técnicas de imágenes se ha logrado diagnosticar de forma segura, se considera que representa hasta el 10% al 30% de todos los casos de síndromes agudos aórticos (4) y el 13% de los casos de disección en donde no se puede identificar el sitio de la ruptura intimal (5). En la mayoría de estudios se ha demostrado que el sangrado en la capa media de la aorta compromete la dinámica de una forma corta y puede ser reabsorbido o progresar a la disección clásica o a una ruptura (6).
Clasificación
La clasificación se basa de acuerdo con el sitio anatómico donde se localiza la disección: 1. Aorta ascendente, a algunos centímetros de la válvula aórtica y 2. Aorta descendente, distal al origen de la arteria subclavia, en el sitio del ligamento arterioso (7).
Se manejan tres sistemas de clasificación que tratan de definir la localización y la extensión:
1. Tipo DeBakey I, II, y III (8).
2. Tipo Stanford A y B (9).
3. Tipo descriptivo anatómico: proximal y distal.
Las clasificaciones tienen un punto común; la tipo I y II de DeBakey comprenden la aorta ascendente, la cual está agrupada de una forma simple por la tipo A de Stanford, y en la clasificación descriptiva, por la proximal (Figura 1).
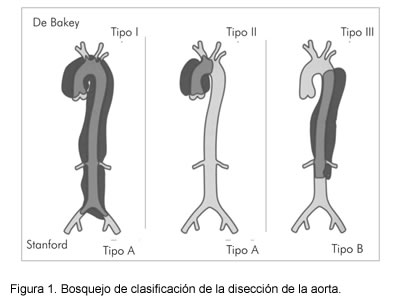
Todas las clasificaciones tienden a facilitar la visión del manejo ya sea de intervención, versus manejo conservador, ya que la actual tendencia hace que la disección que esté comprometiendo la aorta ascendente, se maneje de forma agresiva.
En cuanto a la estadística de presentación de la disección hay una alta tendencia a encontrar el sitio de penetración de la íntima en la aorta ascendente a nivel de la pared derecha lateral, justamente distal al ligamento arterioso, sitio que se presume, presenta el mayor estrés hemodinámico y representa hasta el 65% de los casos (10) mientras 20% se localiza a nivel de la aorta descendente, 10% a nivel del arco aórtico y 5% en la aorta abdominal.
Definición
La disección aórtica fue descrita por vez primera por Nicholls en el 1728; ya en 1826 el Dr. Laennec le aplicó el nombre de aneurysme dissequant, asociando de forma incorrecta la disección con el aneurisma y sin hacer claridad sobre la diferencia de cada una de las entidades, las cuales son completamente diferentes (10).
Cuando se define la disección de la aorta prácticamente se describe la entrada de sangre dentro de las dos terceras partes externas de la media de la aorta, generalmente precediendo a la dilatación del vaso o incluso sin presentarse dilatación del vaso en algún momento del evento.
En la disección aguda las diferentes capas de la pared de la aorta se desgarran, creando una falsa luz que permite correr en paralelo a la luz verdadera. La presión que se crea en el sitio es importante y permite una propagación de la disección a lo largo de toda la longitud de la aorta. Es este el hecho que hace de la disección aórtica el más letal de los eventos que afectan a la aorta, constituyéndose en el evento que mata más personas comparado con las rupturas de aneurisma (11). La prevalencia varía entre los rangos de 0,2% a 0,8% de la población y afecta usualmente a hombres más que a mujeres con una relación similar a la del aneurisma aórtico. El Internacional Registry of Acute Aortic Dissection (IRAD), reporta una mortalidad total hospitalaria del 27% para los pacientes con disección (2).
Etiología
Necrosis quística de la media
Se considera que la degeneración de la media evidenciada por el deterioro del colágeno y la elastina de la media, es lo que lleva a ser un factor que predispone en la mayoría de los casos no traumáticos de disección de aorta (12).
La degeneración quística de la media es un cuadro intrínseco de la mayoría de los defectos hereditarios del tejido conectivo; esto ocurre en pacientes jóvenes con síndrome de Marfan si hay degeneración de la media. La necrosis quística de la media ocurre incluso en pacientes con el síndrome Ehlers- Danlos. El síndrome de Marfan se encuentra involucrado entre 6% a 9% de las etiologías de todas las disecciones de aorta (13).
En ausencia del síndrome de Marfan, la clásica necrosis quística de la media evaluada histológicamente, sólo se identifica en una minoría de los casos en donde hay disección de aorta.
Embarazo
El 50% de las disecciones que ocurren en mujeres jóvenes, menores de 40 años, suceden durante el embarazo (14). En estas pacientes la ruptura comúnmente se produce en el tercer trimestre o en la primera etapa del parto. Las disecciones son del tipo A, y el origen de la ruptura generalmente se establece a dos centímetros de la válvula aórtica. Este tipo de disección se asocia con necrosis quística media o con anormalidades cardiovasculares congénitas, como la coartación de aorta.
Edad avanzada y género
El pico de incidencia de la disección de aorta ocurre en la sexta o séptima décadas de la vida y afecta al grupo de hombres dos veces más que a las mujeres (13).
Hipertensión
Aproximadamente, 90% de los pacientes con disección aórtica tienen hipertensión clínica o historia de hipertensión. La disección ocurre dos a tres veces más en hombres hipertensos y es más común en pacientes de raza negra (15).
Aterosclerosis
La mayoría de veces la aterosclerosis se asocia con disección en los pacientes mayores (16). Los pacientes de edad desarrollan una disección secundaria a una úlcera penetrada aterosclerótica y generalmente conviven con hipertensión arterial. La ruptura de la aorta ocurre en una localización supradiafragmática, lo cual puede resultar en una clásica disección, con una ruptura con reentrada o más comúnmente en una disección trombosada, que también se ha llamado hematoma intramural (17).
Desórdenes endocrinos
Cualquier desorden de este tipo puede llevar, a través del desarrollo de hipertensión, a una disección, como en el caso de una enfermedad de Cushing o un feocromocitoma.
Anormalidades congénitas cardiovasculares
La coartación de aorta, la estenosis aórtica con válvula bicúspide, el ductus arterioso, el defecto septal auricular, los defectos de la válvula tricúspide o la hiperplasia aórtica pueden ser asociadas con la disección de aorta. Aproximadamente, en el 10% de pacientes con coartación de la aorta, la causa de muerte es la ruptura de una disección aneurismática (18). Las disecciones de aorta se han asociado también con los síndromes de Noonan y Turner (13, 19).
Trauma
Éste puede resultar en una ruptura de la íntima y el hematoma disecante, y se ha visto en un trauma de desaceleración brusca, resultando en una ruptura intimal de la aorta descendente torácica en la unión del ligamento arterioso.
Causas iatrogénicas
Las disecciones limitadas o extensas de la aorta pueden resultar de rupturas inadvertidas durante procedimientos percútaneos endovasculares. También se pueden producir luego de circulación extracorpórea, especialmente en los pacientes que han sido expuestos a reemplazos de la válvula aórtica (20).
Úlcera aterosclerótica penetrada
Es una entidad diferente en cuanto a su patología pero se encuentra muy bien asociada con la disección de aorta y la formación de aneurismas. Como entidad fue descrita en 1934 por Shennan, quien identificó una entidad patológica en la cual la ulceración penetra la lámina elástica interna dentro de la media y se encuentra asociada con una variable cantidad de hematoma en la pared de la aorta (21). Las úlceras se hallan con más frecuencia en la parte distal de la aorta descendente, pero pueden presentarse a través de toda la aorta torácica o abdominal, y son bien caracterizadas por la tomografía axial computarizada y las imágenes de resonancia magnética (22).
Hematoma intramural
Esta entidad fue descrita en 1920 como una disección sin ruptura de la íntima. La causa es una ruptura espontánea de la vasa vasorum de la aorta, la cual inicia la desintegración de la pared de la aorta, eventualmente llevando a la disección con o sin ruptura. El término «disección sin flap de la íntima» se aplica corrientemente y es lo que la define en forma adecuada (23). Otros han propuesto la fractura de la íntima de una placa aterosclerótica, como el evento primario que permite la propagación de la sangre dentro de la media de la aorta (24).
Las úlceras ateromatosas que penetran discretamente o incluso las úlceras gigantes penetradas, se han propuesto como un prerrequisito para el hematoma intramural. Tanto la disección de aorta como la úlcera penetrada aterosclerótica, pueden estar acompañadas por un hematoma intramural (25). El engrosamiento localizado de la pared aórtica mayor de 7 mm en una forma circular o de forma creciente en ausencia de un flap de la íntima y que no mejora después de la inyección de contraste en la imagen captada por la tomografía o por la resonancia magnética, se considera como diagnóstico de hematoma intramural (26).
Manifestaciones clínicas de la disección de aorta
Síntomas
El síntoma predominante es el dolor de intensidad severa; su frecuencia en las series es de 74% a 90% (13). El dolor es mórbido, como si se estuviera rompiendo o desgarrando, también es algo frecuente describir que el dolor migra hasta en 70% de los casos, del sitio de origen a otros sitios por donde va la disección (27).
La ubicación del dolor sugiere el sitio de la disección; en la serie de Spittell y colaboradores (13) cuando el dolor era anterior, en el 90% de los casos la disección comprometía la aorta ascendente. Cuando el dolor era interescapular en el 90% tenía comprometida la aorta descendente. La presencia de dolor en cuello, garganta, mandíbula o cara predice el compromiso de la aorta ascendente. Si el dolor se irradia a espalda, abdomen o extremidades inferiores se predice compromiso de la aorta descendente.
Dentro de los síntomas que pueden acompañar la disección se encuentran: falla cardiaca, síncope, accidente cerebrovascular, neuropatía periférica, isquemia, paraplejía y muerte súbita.
La presencia de síncope hasta en 4% a 5% de los casos, es un signo ominoso que sugiere una emergencia quirúrgica, asociado a la disección de la aorta en forma proximal (13, 27).
Hallazgos físicos
La presentación o no de los signos que acompañan una disección es muy variable; en algunos casos el solo hecho de su aparición hace el diagnóstico, sin embargo su ausencia no descarta la disección.
La hipertensión arterial se asocia en 80% a 90% con casos de disección distal.
La hipotensión ocurre más frecuentemente en la disección proximal y es secundaria a ruptura intrapleural, taponamiento pericárdico o ruptura intraperitoneal.
Se puede dar el caso de una seudohipotensión cuando la disección compromete los vasos braquiocefálicos, originando déficit de pulso y soplo de la regurgitación aórtica; las manifestaciones neurológicas pueden presentarse dependiendo del nivel anatómico de la disección (28).
En 1% a 2% de los casos una disección muy proximal puede comprometer el ostium de las arterias coronarias produciendo infarto del miocardio. La mayoría de las disecciones compromete la arteria coronaria derecha. Son manifestaciones adicionales poco frecuentes: derrame pleural, voz ronca, obstrucción de vías aéreas, hemoptisis, disfagia, síndrome de vena cava superior, soplos continuos por ruptura a las aurículas o a los ventrículos y masa pulsátil en cuello (13, 29, 30). También se pueden presentar una serie de condiciones que pueden confundir el cuadro; éstas son: infarto agudo del miocardio o isquemia aguda, regurgitación aórtica aguda sin disección, aneurisma aórtico abdominal o torácico sin disección, pericarditis, tumores mediastinales y dolores músculo-esqueléticos (31).
Métodos diagnósticos en la disección aórtica
Generalmente, un alto índice de sospecha clínica es más importante que los métodos diagnósticos en sí cuando se evalúa un paciente con sospecha de disección aórtica (32). Sin embargo, los métodos diagnósticos no invasivos permiten llegar a un diagnóstico preciso en la mayoría de los pacientes (32) y su elección depende, además de sus ventajas y desventajas, de la disponibilidad y experiencia que tenga cada institución y del estado hemodinámico del paciente. En la tabla 1 se enumeran los objetivos diagnósticos de los métodos imaginológicos.

Radiografía simple de tórax
Aunque algunos autores sugieren que los rayos X de tórax tienen alta precisión diagnóstica (33), su principal utilidad yace a la hora de confirmar la sospecha clínica de la enfermedad y permitir al evaluador inicial justificar el uso de ayudas diagnósticas más específicas.
En menos del 30% de los pacientes se observan signos inequívocos de disección (34).
En cuanto a los signos radiológicos las anormalidades en la silueta aórtica se presentan como el hallazgo más común (2, 35) y en la mayoría de los pacientes (80%-90%) se observa ensanchamiento del mediastino, sobre todo en la disección de la aorta ascendente, que se ve más hacia el lado izquierdo y está acompañado de la pérdida de los contornos cardiacos cuando hay derrame pericárdico asociado. Se puede observar derrame pleural, por lo general izquierdo. Otros signos radiográficos son: borramiento o ensanchamiento del botón aórtico, desviación de la tráquea, signos de falla cardiaca, ensanchamiento de la aorta ascendente o descendente, en-sanchamiento de la línea y una distancia mayor de 6 mm entre una calcificación intimal y el contorno externo de la pared aórtica, paraespinal, el cual es un signo muy referido pero poco específico (Figura 2).
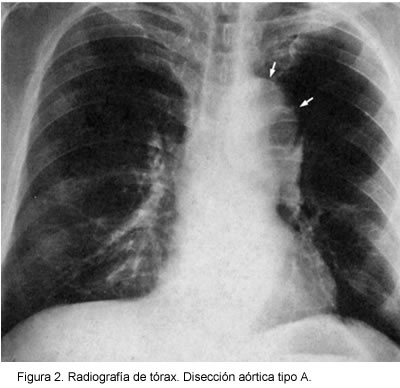
Este estudio posee poca especificidad, algo evidente cuando un ensanchamiento sustancial de la aorta ascendente está confinado al área retroesternal, donde se observa la silueta aórtica normal (36).
Ecocardiografía transtorácica
Su sensibilidad varía entre el 50% y el 85% (37) siendo mayor para la disección en la aorta ascendente, y menor para la aorta descendente, donde sólo se acerca al 60%. Su especificidad varía entre el 70% y el 90% (38).
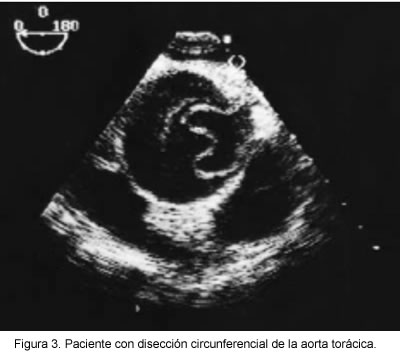
Para realizar el diagnóstico ecocardiográfico se debe evaluar la aorta en toda su extensión (11, 13) y es necesario visualizar la presencia del colgajo (flap) íntimo medial que divide la aorta en dos luces, la verdadera y la falsa, el cual debe tener un movimiento paradójico, además de existir un patrón diferencial de color entre el flujo del lumen verdadero y el lumen falso. Cuando lo anterior se suma a la dilatación de la raíz y las paredes aórticas, el valor predictivo positivo de la ecocardiografía transtorácica es del 100% (39) (Figura 3).
Ecocardiografía transesofágica
Ofrece una evaluación precisa y rápida, e incluso es el método diagnóstico inicial de elección (40). A pesar de que requiere mayor habilidad técnica y colaboración del paciente, es superior a la ecocardiografía transtorácica pues es un método rápido, portátil y mínimamente invasivo, que se acompaña de menos morbilidad (38).
Se puede realizar a la cabecera del paciente y es relativamente de bajo costo (41, 42). Es útil al inspeccionar la aorta ascendente y descendente, pero no para estudiar el arco aórtico y la porción más alta de la aorta ascendente por la interposición de la tráquea y el bronquio principal izquierdo, aunque es muy raro que una disección se localice exclusivamente en esa región (43).
Su sensibilidad varía entre 77% y 88% y su especificidad entre 93% y 96%, las cuales aumentan cuando se usa en combinación con la ecocardiografía transtorácica a 99% y 98% respectivamente (44). Su sensibilidad global es comparable con la de la tomografía axial computarizada (TAC), la resonancia magnética nuclear (45, 46) y la aortografía (47) y aunque algunos autores han concluido que la precisión en el diagnóstico es del 93% con angiografía, 74% con TAC y 69% con ecocardiografía (48), el estudio Cooperativo Europeo (37), demostró que cuando se combina ecocardiografía transtorácica con ecocardiografía transesofágica (monoplanar), la sensibilidad aumenta a 99% y la especificidad a 98% para el diagnóstico, comparado con la TAC que tiene una sensibilidad y una especificidad del 83% y del 100% respectivamente y de 88% y 94% al comparar con la angiografía (49, 50). En resumen, la sensibilidad, la especificidad y los valores predictivos están por encima del 95,9% (51, 52).
Tomografía axial computarizada
La TAC con medio de contraste intravenoso puede demostrar de manera precisa el colgajo intimal, el cual es el principal criterio diagnóstico junto con la presencia de trombo o calcificación intramural (52), el llenado tardío del lumen falso y el ensanchamiento aórtico. Además, puede evidenciar si hay derrame pleural o pericárdico, hemorragia mediastinal asociada o compromiso de la aorta abdominal, y en caso de detectar dilataciones aneurismáticas puede identificar qué tan propensas son a la ruptura o disección (53). Sin embargo, a menudo falla al intentar determinar el sitio de entrada o reentrada, la insuficiencia aórtica asociada o el compromiso de las ramas aórticas. Otras desventajas adicionales de la TAC incluyen la necesidad de utilizar medios de contraste, exposición a rayos X y que no es portátil, por lo que su uso en el paciente que se encuentra hemodinámicamente inestable es limitado (54).
Su sensibilidad varía desde 93% a 100% y su especificidad de 87% a 100% (51). Cuando ocurre imprecisión en el diagnóstico puede ser por opacificación inadecuada, o porque no se logra visualizar el colgajo intimal, artificios, hay mala interpretación de los vasos adyacentes o de un seno de vasalva prominente que tenga la apariencia del colgajo, o cuando se presentan concomitantemente atelectasias, engrosamiento pleural o trombosis de la falsa luz que alteran la interpretación por parte del evaluador.
Sin embargo, muchas de estas limitaciones se disminuyen cuando se utilizan tomógrafos helicoidales que disminuyen el efecto producido por los movimientos respiratorios (55), por lo que se considera como principal modalidad diagnóstica en los pacientes con aneurismas y disección aórtica (56).
Resonancia magnética nuclear
La resonancia magnética nuclear (RMN) puede considerarse la técnica más completa para la evaluación de esta patología, pues permite una evaluación exhaustiva de la morfología aórtica y de las estructuras que la rodean (57). Es superior a la ecocardiografía transtorácica y la TAC para detectar el compromiso del arco aórtico y disecciones tipo A y tipo B (12); muestra los cambios ateroscleróticos de la íntima (incluso en estadios tempranos y con diferentes composición lipídica), ayuda a diferenciar entre un hematoma periaórtico y la trombosis de un falso aneurisma (58) y puede facilitar la comparación de estudios seriados. Adicionalmente, muestra de manera muy precisa el sitio de entrada, la presencia de la ruptura de la placa de manera patológica o iatrogénica, y el colgajo intimal, por lo cual se la considera como el método óptimo para evidenciar la formación del trombo y la localización exacta de la entrada de la disección en todos los segmentos de la aorta (59). Por su habilidad para obtener cortes oblicuos y longitudinales, posee un valor especial para el abordaje diagnóstico de las disecciones sin desgarro intimal.
Generalmente, la técnica estándar no requiere el uso de medio de contraste y en ciertas aplicaciones un estudio simple de RMN puede proveer información similar a aquella que brinda la combinación de ecocardiografía, TAC y angiografía (60, 61). Por otro lado, la RMN en tiempo real, la cual se encuentra en los más avanzados scanner, facilita la evaluación rápida y precisa, incluso en el paciente inestable (62).
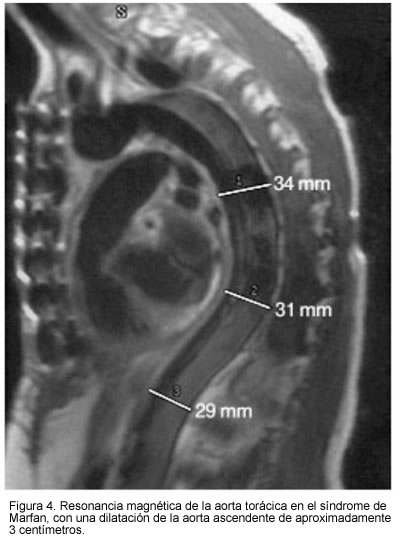
Entre los hallazgos que muestra la RMN en la disección aórtica, se puede apreciar claramente la extensión; de igual manera, con este método se puede realizar fácilmente la clasificación de la disección, así como la evaluación de signos adversos como derrame pleural e insuficiencia aórtica, esta última no evaluable por la TAC, y la cuantificación del flujo entre la luz falsa y verdadera por medio de cine-resonancia magnética con contraste de fase, que además permite la visualización de la porción inicial de las arterias coronarias (63, 64). La resonancia magnética permite incluso la detección de hemorragias intramurales agudas y subagudas, que se observan típicamente como una pared engrosada (mayor de 7 mm) con una superficie lisa y que puede contener áreas hiperintensas. Cuando éstas se presentan en la aorta torácica es necesario evaluar la aorta abdominal para descartar disección verdadera de este segmento, pues frecuentemente están asociados (Figura 4).
A pesar de que la sensibilidad y especificidad de este método son cercanas al 100%, cierto tipo de artificios se presentan hasta en el 64% de los pacientes, pero la mayoría de éstos únicamente se observa en un solo corte imaginológico.
Angiografía (aortografía)
La aortografía ha sido el método de elección clásico en manos expertas desde que Robb y Steinberg en 1939 reportaron por primera vez el diagnóstico de disección aórtica, adquiriendo su mayor apogeo a partir de la década de los sesenta (65). Es de gran valor pues tiene un buen rendimiento diagnóstico, es segura, bien tolerada -incluso en el paciente en estado crítico- y tiene la ventaja de visualizar las ramas aórticas, incluidas las coronarias, lo que es primordial a la hora de descartar complicaciones en pacientes con signos y síntomas neurológicos, falla renal aguda, crisis hipertensiva o sospecha de isquemia mesentérica o de extremidades. Igualmente, sirve para determinar el abordaje quirúrgico o percútaneo y para realizar las modificaciones pertinentes según la anatomía.
Permite localizar el sitio de origen del desgarro intimal y delinear su extensión, así como la circulación de órganos vitales; puede distinguir los dos lúmenes, estratificar la severidad de la insuficiencia aórtica y mostrar si hay ruptura en la cavidad pericárdica, en las aurículas, en el ventrículo derecho o en la arteria pulmonar.
Para realizar el diagnóstico a través de este método se deben visualizar los signos directos que incluyen la opacificación del falso lumen y la presencia de desgarro intimal (imagen de defecto intraluminal, a menudo móvil y lineal); además, signos indirectos entre los que se encuentran: deformidad de la luz verdadera causada por el falso lumen, engrosamiento de las paredes vasculares mayor a 5 mm, pérdida de los contornos de los vasos, rigidez a la compresión, ensanchamiento de la aorta, oclusión de los ramos de la aorta y presencia de insuficiencia aórtica (66). La diferencia básica entre la evaluación radiológica de los dos lúmenes, se encuentra al observar que la luz verdadera tiene forma de espiral, mientras que la luz falsa se caracteriza por la ausencia de ramas o la clásica configuración del seno de vasalva con llenado tardío del medio de contraste (67) (Figura 5).
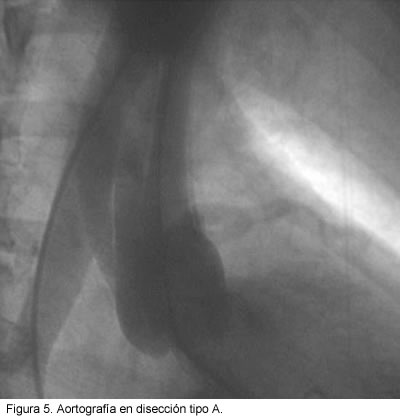
Según diferentes estudios comparativos la aortografía posee especificidad del 94% y sensibilidad del 88% (68, 69); esta última es inferior a la de las otras técnicas, sobre todo cuando se trata de presentaciones atípicas de la disección (70). Al comparar el ultrasonido, la tac y la aortografía se ha reportado una precisión para el diagnóstico del 69%, 74% y 93% respectivamente (48). Los falsos negativos ocurren cuando hay opacificación simultánea y de igual intensidad en los dos lúmenes o cuando el falso canal sólo se opacifica de manera tenue (31).
La angiografía coronaria continúa siendo el patrón de oro para detectar el compromiso del ostium coronario; además, la enfermedad aterosclerótica coronaria se presenta de manera concomitante hasta en el 25% de los pacientes con disección aórtica. Por esto, algunos autores recomiendan su realización en todos los pacientes estables, particularmente con disección tipo B (tipo III) donde puede adicionar información importante para estatificar la fase crónica de la enfermedad. Sin embargo, la respuesta sobre si es imperativo o no realizarla en quienes se consideran candidatos para el manejo quirúrgico abierto, permanece sin respuesta (71).
Nuevas técnicas y avances que mejoran y superan la angiografía
En los centros donde se encuentra disponible, la angiotomografía y la angiografía de sustracción digital, han reemplazado significativamente la angiografía convencional en los pacientes con sospecha de patología aórtica (72). Por otro lado, la angiorresonancia representa un innovador método que se puede realizar rápidamente, que aporta una excelente calidad de imagen y que posee dos ventajas fundamentales: utiliza medios de contraste que no son nefrotóxicos y no presenta radiación ionizante.
Ultrasonido endovascular
El uso del ultrasonido endovascular (IVUS) se ha propuesto para complementar la información angiográfica, mejorando muchas de las desventajas inherentes de la aortografía. Visualiza de manera directa las estructuras desde el interior del lumen aórtico. En los pacientes con las presentaciones clásicas de la enfermedad, visualiza el colgajo intimal, su movimiento, la extensión longitudinal y circunferencial y el grado de compromiso luminar. Su sensibilidad y especificidad se acerca al 100% (73) y su principal papel se presenta en los pacientes con fuerte sospecha de disección pero con aortografía normal.
Como una modalidad coadyuvante, el IVUS tiene gran utilidad para la implantación de stent en la disección aórtica, particularmente la tipo B y con extensión abdominal. Tiene alta capacidad para diferenciar entre la verdadera y falsa luz y para identificar la anatomía propia de la aorta (74); además, sobre las demás técnicas diagnósticas, tiene la ventaja de detectar la arteria visceral en la disección y clarificar el mecanismo de la isquemia visceral (75). También puede predecir la formación de trombos y los cambios debidos a hemorragia de la pared aórtica por el engrosamiento que se observa en la misma (73).
Historia natural y evolución del tratamiento quirúrgico de la disección
En la disección clasificada como Stanford tipo A, la intervención quirúrgica se realiza inmediatamente luego de realizar el diagnóstico para evitar el alto riesgo de muerte que inducen las complicaciones inherentes a este desastre, entre las que figuran el taponamiento cardiaco, la insuficiencia aórtica y el infarto de miocardio (76).
El no tratar la disección tipo A está asociado con una mortalidad del 1% al 2% por cada hora dentro de las primeras 24 a 48 horas. La experiencia de Stanford reveló que la mortalidad operativa para la disección aguda tipo A fue 7%; cuando se trata de una disección crónica tipo A, la mortalidad de la cirugía es del 11%. En los 5 años de seguimiento, la sobrevida de los pacientes fue de 78% para las disecciones tipo A (77).
Cuando se trata del manejo de los pacientes con disección de la aorta descendente o Stanford tipo B, se encuentra menos definida la conducta (78). La terapia se ha basado en el uso de betabloqueadores como la terapia primaria, asociándose a una mortalidad intrahospitalaria de 10% a 15%, con una muy significativa morbilidad a largo tiempo por la formación de dilataciones aneurismáticas de la falsa luz (78).
El tratamiento quirúrgico se ha reservado para complicaciones específicas: dolor intratable, ruptura inminente, síndromes de mala perfusión y expansión temprana mayor de un diámetro de 5 cm (10, 79, 80). Otras condiciones que pueden acelerar la tomas de decisión de una cirugía temprana incluyen: síndrome de Marfan, localización de un falso aneurisma de importante tamaño en la aorta descendente proximal que comprometa el arco aórtico, y mala tolerancia al tratamiento médico (81, 82).
El procedimiento quirúrgico para este tipo de pacientes complicados, se ha asociado con una frecuencia de mortalidad del 60% al 70%, especialmente por el compromiso impredecible de la perfusión periférica. La sobrevida para todos los pacientes con disección tipo B fue de 65% al primer año y de 50% a los 5 años. De forma más específica, la sobrevida fue del 73% al año y 58% a los 5 años para los pacientes en tratamiento médico, y 47% al año y 28% a los 5 años para pacientes con tratamiento quirúrgico (83). Sin embargo, no es válido realizar una comparación en las dos cohortes de pacientes, ya que los pacientes quirúrgicos están seleccionados por sus complicaciones, lo que hace más alta la mortalidad inherente (84).
La intervención quirúrgica para el manejo de la disección tipo B se limita a estas indicaciones:
1. Ruptura aórtica aguda: requiere cirugía urgente con alta mortalidad.
2. Agrandamiento de la luz falsa del aneurisma: usualmente ocurre en los cuadros crónicos después de un estado de estabilización.
3. Compromiso de ramas arteriales con compromiso de arterias renales, vasos mesentéricos o arterias ilíacas.
4. Desarrollo de paraplejías: esto ocurre cuando se comprometen las arterias espinales que se originan de las arterias intercostales o lumbares.
Terapia endovascular
Al establecer el diagnóstico de pacientes con una sospecha de disección de aorta, la descripción de la anatomía y el estado vascular es de fundamental importancia. Aquí es crítico definir los puntos de entrada y posibles puntos de reentrada, diámetros de la disección, estado de mala perfusión, es decir, el reconocimiento de la luz verdadera frente a la luz falsa, y longitud de la disección. Se deben realizar los diferentes métodos de diagnóstico imaginológicos (definidos en un aparte anterior) para dar claridad al diagnóstico; incluso la realización de una angiografía nuevamente ha surgido como un método, el cual, en casos complejos, se usa para definir los estados de perfusión selectivos de órganos diversos y situaciones de isquemia estática e isquemia dinámica, para finalmente evaluar la posibilidad de realizar una terapia endovascular (85).
En la disección de aorta puede ser de gran utilidad el uso del dispositivo stent con injerto (86-90). Para la disección Stanford tipo A, con compromiso de la aorta ascendente, se indica la reparación quirúrgica. La reparación agresiva de las disecciones agudas tipo A se realizan en un esfuerzo de minimizar complicaciones tardías como la formación de aneurismas; es aquí donde la propuesta de Kazui y colaboradores juega su papel. En un esfuerzo para minimizar estas complicaciones tardías, Kasui ha propuesto un reemplazo de la zona del arco y la aorta ascendente, con una mortalidad aceptable (91). En pacientes jóvenes o en aquellos que se encuentran con síndrome de Marfan, las complicaciones aneurismáticas son más propensas a desarrollarse tarde en el curso de una disección crónica. Los cambios aneurismáticos del arco transverso son los que presentan un problema particular. Los subsecuentes cambios degenerativos aneurismáticos podrían limitarse a la aorta descendente y a la aorta abdominal, lo cual se maneja con mayor facilidad si el arco ya está reparado. Algunos autores se han adherido a este argumento como un paso para luego proponer una inserción de un stent con injerto, ambos para minimizar la formación tardía de aneurisma como también para promover la trombosis de la falsa luz, aboliendo una doble luz aórtica (90). Para la disección tipo B, tanto en el compromiso toraco-abdominal como en el torácico, los resultados adversos de la cirugía han animado el manejo intensivo médico para llevar a la estabilización, especialmente en casos no complicados.
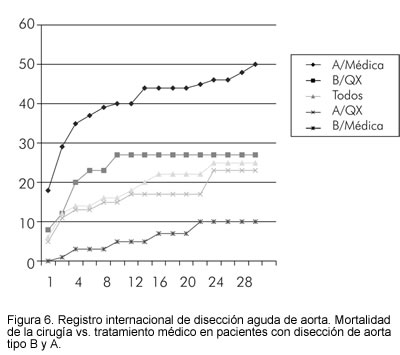
De acuerdo con el Registro Internacional de Disección Aguda de Aorta (IRAD), la mortalidad para pacientes con disección tipo B sometidos a cirugía, fue del 31,4%, mientras que los pacientes que fueron tratados médicamente tenían una más baja mortalidad (10,7%) (2) (Figura 6).
Casos complicados como: inminente ruptura, evidencia de pérdida sanguínea o síndrome de mala perfusión de algún tipo, pueden calificar para la opción de tratamiento endovascular. Las indicaciones no están todavía codificadas en un consenso y por ello se está formando para seleccionar casos de complicaciones agudas y casos crónicos que estén con evidencia de expansión aneurismática de la aorta disecada para proponer una intervención percutánea, como se establece en la tabla 2.

Son escasos los procedimientos en los cuales se requiere un moldeamiento cuidadoso realizado con balón, provocado por una expansión incompleta; este procedimiento sólo debe llevarse a cabo en presencia de bajas presiones sistólicas, tan bajas como 60 mm Hg por cortos momentos.
1. Colocar el stent injerto previene la ruptura y la dilatación.
2. El uso del stent injerto previene la formación de trombo en la falsa luz.
3. El uso del stent injerto previene la presencia de dolor e isquemia en los órganos.
4. Seguimiento de todos los pacientes con imágenes obtenidas de ultrasonido transesofágico, tomografía computarizada o resonancia magnética.
El consenso para el tratamiento de la disección crónica es similar a la del aneurisma aórtico torácico no disecado (85). Se ha demostrado que hay riesgo de ruptura incluso en los pequeños diámetros. Esta razón ha hecho que se indique la intervención en diámetros mayores de 5 cm, sin descuidar los diámetros menores con características de inestabilidad.
En cuanto al hematoma intramural aórtico, entidad que se incluye entre los síndromes aórticos agudos, es de difícil diferenciación con la disección clásica en cuanto a su clínica; representa el 10% al 30% de todos los casos. En estudios generales se ha demostrado que el sangrado en la capa media de la aorta es el proceso dinámico en el corto tiempo, pero que luego se reabsorbe o hace su progreso a la disección o hacia una ruptura aórtica. Como entidad muestra una mortalidad en los primeros tres meses de evolución, tan alta como del 19%, con el factor más determinante que es el diámetro máximo (más de 5 cm) como también su localización en la aorta ascendente. Pacientes con diámetros por encima de 5 cm tienen una mortalidad por encima del 50%, a diferencia de diámetros menores a éste que muestran un 2%. Igual circunstancia se da en la localización, siendo un 50% de mortalidad en la aorta ascendente y un 12% cuando se encuentra localizada en la parte descendente o en el arco aórtico (92). De acuerdo con estos datos, es claro que se debe dar un abordaje agresivo, con intervención quirúrgica a los pacientes con diagnóstico de hematoma intramural aórtico, que presenten diámetros de 5 cm o más y que tengan localización en la aorta ascendente, al igual que se debe recomendar el tratamiento endovascular con stent con injerto en la presencia de esta entidad en la aorta descendente.
En la úlcera penetrada de aorta, ya definida en un aparte anterior, en su historia natural tiende a formar un hematoma intramural o un falso aneurisma, o llevar a la ruptura. Ese riesgo de ruptura está en 40%, lo cual hace que el acercamiento terapéutico sea inicialmente médico si la úlcera está penetrada en la aorta descendente y no presenta complicaciones asociadas y que al contrario se ofrezca una corrección vía endovascular con stent con injerto para pacientes con aneurismas falsos y rupturas verdaderas (25, 93).
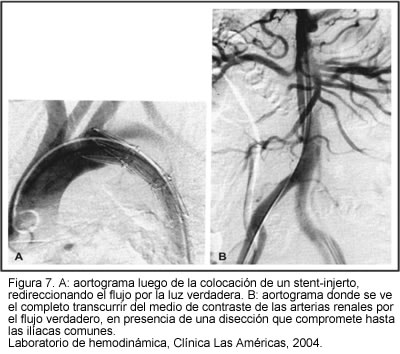
La tecnología del stent injerto ofrece muchas ventajas nuevas (92). La aplicación de este tipo de stent podría afectar profundamente la historia natural de la disección de aorta. El cubrimiento de la ruptura de la íntima redirecciona el flujo dentro de la luz verdadera, lo cual no sólo proporciona protección de la ruptura, sino que incluso elimina la mala perfusión que resulta de la obstrucción dinámica (colapso de la luz verdadera) que ocurre en casi todos los pacientes (94). El llenamiento de la luz falsa, con el riesgo de una ruptura de la dilatación aneurismática, es eliminado y la trombosis de la falsa luz resulta en la formación de un simple recipiente aórtico inerte (95). El procedimiento es realizado bajo visión fluoroscópica, en el servicio de hemodinámica; allí se puede poner de manifiesto una mala perfusión secundaria a una obstrucción estática no corregida, la cual puede ser corregida por un stent no cubierto dentro de la luz verdadera (94).
Este es un procedimiento que tiene mayor factibilidad y menos morbilidad que un procedimiento quirúrgico. El stent injerto no requiere ser muy largo; raramente se extiende en foma distal hasta el cuerpo vertebral T-6, lo cual minimiza el riesgo de presentación de paraplejía. En diferentes reportes de series, se reportaron exitosamente 12 a 15 disecciones tipo B complicadas con este método, mostrando una mortalidad de sólo el 20%, con una restauración de la luz de la aorta en un 70% a 80% de los pacientes (94). Considerando que el procedimiento de colocación del dispositivo es de un corto tiempo y de una aproximación mínimamente invasiva, se perfila como una alternativa excelente de uso en casos de emergencia en donde hay evidencia de contenido o sangrado activo del sitio de perforación en la aorta descendente. Algunos autores han reportado experiencias en casos separados y en series pequeñas de pacientes tratados para una ruptura aórtica aguda con implantación de stent con injerto (96, 97). En una serie reciente de 31 pacientes tratados consecutivamente bajo tratamiento endovascular emergente, se intervinieron exitosamente lesiones penetrantes agudas de la aorta descendente, con cubrimiento adecuado de la zona de ruptura en la pared aórtica, con una mortalidad temprana de 9,7%, relacionando la muerte con una recurrencia de la ruptura, falla multiorgánica y síndrome de bajo gasto, respectivamente (98).
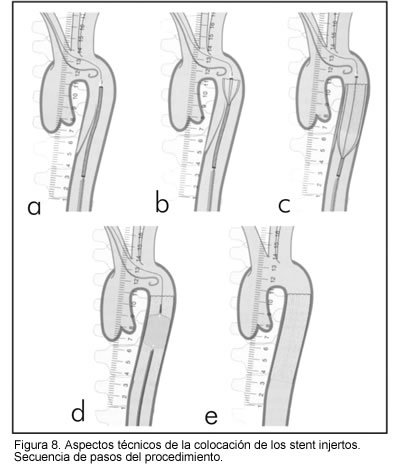
Aspectos técnicos de la implantación de stent - injerto en las disecciones
1. Implantar catéter cola de puerco en el arco aórtico vía arteria braquial derecha o izquierda.
2. Acceder de la arteria femoral.
3. Pasar simultáneamente del catéter cola de puerco en arco aórtico (vía braquial) y catéter cola de puerco en aorta descendente (vía femoral), para orientar de forma segura el paso de la guía en la luz verdadera.
4. Verificar la posición de la guía con la ayuda de una angiografía y una ecocardiografía transesofágica.
5. De ser posible, pasar por la ingle opuesta un ultrasonido intravascular para realizar así un estudio de la disección, con sus entradas y salidas, al igual que los orígenes de los vasos, posición de los catéteres y guías.
6. Las características del stent - injerto están condicionadas por la localización, el tamaño y el número de entradas torácicas y por el tamaño del tracto dilatado.
Limitaciones y complicaciones de la técnica endovascular
No se debe descartar la posibilidad de daño iatrogénico durante la instrumentación para la colocación del stent injerto (99).
1. En las fases agudas, la pared externa del lumen falso es delgado y friable, y la adventicia se torna una capa de fácil perforación inducida por la guía, hecho que es una catástrofe.
2. Existe la posibilidad de la disección del septum producida por la fijación del stent injerto en su parte distal.
3. Se reportan falsos aneurismas formados luego de colocar el stent, especialmente en el arco transverso en la parte proximal no cubierta.
4. Si la parte de la ruptura intimal es muy extensa y llega a comprometer la parte proximal, llegando hasta el orificio de salida de la arteria subclavia izquierda, esta situación obligaría a una implantación del stent injerto, justamente distal a la arteria carótida izquierda, cubriéndose el orificio de la subclavia. Incluso se ha sugerido que la arteria subclavia izquierda pueda ser excluida impunemente. Con la técnica Stanford se ha creado un puente de carótida izquierda a subclavia ya sea por transposición o colocación de un puente, ligando la subclavia izquierda en la parte proximal de la arteria vertebral, lo cual elimina la posibilidad de llenamiento retrógrado (100, 101). Se ha planteado una alternativa implementada por el Dr. Inoue, que consiste en la colocación de un stent injerto ramificado para la arteria subclavia izquierda (102).
Preguntas y expectativas con respecto a la nueva tecnología
Hay muchos interrogantes que permanecen sin una respuesta adecuada en esta nueva tecnología. Los orígenes de las diferentes ramas de vasos críticos de la aorta, tanto de la luz verdadera como de la falsa y el hecho de presentarse múltiples comunicaciones entre las luces verdaderas y falsas, hacen que se presenten muchas limitantes en la tecnología del stent injerto.
En 10 años de experiencia en la reparación de aneurismas de aorta abdominal, se ha obtenido una información importante en relación con los diseños y su comportamiento. La agudeza (perfil), su flexibilidad, el estar sobre la guía en el sistema de entrega (da la posibilidad de bajar el diámetro al dispositivo, por debajo de 20 French), hace que con los dispositivos actuales raramente falle el paso por arterias ilíacas tortuosas. Sin embargo, persisten una serie de aspectos técnicos que deben tenerse en cuenta al momento de usar los dispositivos:
1. La alta incidencia de producción de tromboembolia desencadenada por la proximidad y manipulación del catéter en arco aórtico y aorta ascendente. Incluso es posible desencadenar un evento tromboembólico, sólo con el paso de la guía de soporte alto en pacientes con enfermedad ateromatosa severa.
2. La sobreposición de los dispositivos de injerto produce un efecto de estrés que es inusual y puede llevar a una falla tardía.
3. Hay un aumento del estrés sobre el dispositivo en las áreas de angulación, predisponiendo a la fatiga del material y su posterior fractura.
4. Ya que debe haber una buena disposición desde el punto de vista anatómico el aspecto anatómico es una limitación importante del segmento comprometido, así como un adecuado cuello proximal y distal para la colocación adecuada del dispositivo.
5. El compromiso de ramas críticas de la aorta al igual que los trayectos relativamente rectos, son los que presentan un perfil adecuado para ser manejado con esta técnica.
6. La estructura de stent injertos de diseño modular se torna más versátil que los de un solo cuerpo; esto facilita la navegabilidad del dispositivo.
Lo fundamental en esta nueva tecnología es el seguimiento que debe mantenerse en los pacientes intervenidos. En el registro del estudio Eurostar, más del 10% de los pacientes por año requieren un procedimiento secundario para asegurar la exclusión del saco aneurismático (103). Si no se logra el sellado definitivo del saco aneurismático, la protección de evitar una ruptura no se alcanza; esto hace fundamental el seguimiento longitudinal.
El último estudio que completó seis años de seguimiento en el manejo de la dissección de aorta y el comportamiento de la falsa luz, mostró cómo esta falsa luz desapareció totalmente en 76% de los cuadros realizados en estados agudos de disección, con sólo un 36% de las disecciones realizadas en estados crónicos (104).
Se investigó si las ventajas de la reparación endovascular se sostenían más allá del periodo perioperatorio; para tal motivo se condujo un estudio multicéntrico, aleatorizado que comparó la reparación quirúrgica con la reparación vía endovascular usando el stent injerto, en 351 pacientes quienes tuvieron el diagnóstico de aneurisma de aorta de al menos 5 cm de diámetro y quienes fueron considerados candidatos para cualquiera de los dos métodos de reparación. Dos años luego de la aleatorización, la sobrevida acumulada fue de 89,6% para la reparación quirúrgica y de 89,7% para la reparación endovascular. La frecuencia acumulada de muertes relacionadas con el aneurisma fue de 5,7% para la reparación quirúrgica y 2,1% para la endovascular. Esta ventaja del procedimiento endovascular sobre el quirúrgico fue fundamentada en los eventos ocurridos en el periodo perioperatorio, sin diferencias significativas en la subsecuente mortalidad relacionada con el aneurisma. La frecuencia de la sobrevida libre de complicaciones severas a moderadas fue incluso similar en los dos grupos en el seguimiento a dos años (65,9% cirugía y 65,6% para endovascular), lo que muestra que la ventaja vista tempranamente no se mantiene a los dos años en el método endovascular (105).
Alternativas de dispositivos
Hay alternativas en presentaciones que se encuentran comercializadas y otras que se encuentran bajo evaluación, incluyendo el Talent de Medtronic (Figura 5) y una nueva versión del Gore Excluder, al igual que otros stent injerto torácico evolución de los stent abdominales ya manufacturados. La vasta mayoría de stent injerto es construida individualmente en varios centros. Las nuevas generaciones que entrarán a suplementar los actuales diseños, incluirán un perfil bajo, gran flexibilidad, incremento en la comodidad, mayor facilidad de inserción y entrega; todo esto lleva a una ventaja en la reducción del tiempo de colocación, menos pérdida sanguínea, bajas estancias hospitalarias y disminución de las complicaciones y la mortalidad en general.

Conclusiones
El tratamiento de la patología aórtica torácica se complica por la alta morbilidad y mortalidad que se asocia con los manejos quirúrgicos; al mismo tiempo esta patología se encuentra con la mayor prevalencia en edades mayores, donde la población es más frágil y la concurrencia de enfermedades crónicas y degenerativas hacen que las alternativas de corrección quirúrgica de los síndromes aórticos no sean las mejores opciones e incluso en momentos sean prohibidas. Debido a esta razón la alternativa del uso de métodos menos invasivos como los tratamientos endovasculares, están ganando un puesto relevante.
Los diferentes estudios y descripciones de series, cada vez mayores, de casos de correcciones de patología aórtica del tipo de disecciones agudas o úlceras y hematomas con dispositivos tipo stent injerto de forma exitosa son alentadores y dan una opción ya reconocida, aunque están aún en una etapa de desarrollo.
El avance en el conocimiento de la enfermedad hará que se creen mejores dispositivos con mejores perfiles, que den alternativas seguras para una entidad de baja ocurrencia pero catastrófica cuando se presenta.
Bibliografía
1. Wheat MW, Jr. Acute dissecting aneurysms of the aorta: diagnosis and treatment. 1979 Am Heart J 1980; 99: 373. [ Links ]
2. Hagan PG, Nienaber CA, Isselbacher EM, et al. The international registry of acute aortic dissection (IRAD) - New insights into an old disease. JAMA 2000; 283: 897-903. [ Links ]
3. Crawford ES, Coselli JS, Svensson LG, et al. Diffuse aneurysmal disease (chronic aortic dissecction, Marfan, and mega aorta syndromes) and multiple aneurysm. Ann Surg 1990; 211: 521. [ Links ]
4. Vilacosta I, San Roman JA, Ferreiros J, et al. Natural history and serial morphology of aortic intramural hematoma: a novel variant of aortic dissection. Am Heart J 1997; 134: 495-507. [ Links ]
5. Wilson SK, Hutchins GM. Aortic dissecting aneurysms: causative factors in 204 subjets. Arch Pathol Lab Med 1982; 106: 175. [ Links ]
6. Nienaber CA , Von Kodolitsch Y, Petersen B, et al. Intramural hemorrhage of the toracic aorta. Diagnostic and therapeutic implications. Circulation 1995; 92: 1465-72. [ Links ]
7. Roberts WC. Aortic disection: anatomy, consequences, and causes. Am Heart J 1981; 101: 195. [ Links ]
8. DeBakey ME, McCollum CH, Crawford ES, et al. Dissection and dissecting aneurysm of the aorta: twenty year follow-up of five hundred twenty-seven patients treated surgically. Surgery 1982; 92: 1118. [ Links ]
9. Daily PO, Trueblood HW, Stinson EB, et al. Management of acute aortic dissections. Ann Thorac Surg 1970; 10: 237. [ Links ]
10. Elefteriades JA, Hartleroad J, Gusberg RJ, et al. Long-term experience with descending aortic dissection: The complication-specific approach. Ann Thorac Surg 1992; 53: 11. [ Links ]
11. Glower DD, Fann JI, Séller RH, et al. Comparison of medical and surgical therapy for uncomplicated descending aortic dissection. Circulation 1990; 82: 39. [ Links ]
12. Marsalese DL, Moodie DS, Lytle BW, et al. Cystic medial necrosis of the aorta in patients without Marfans síndrome: surgical outcome and long term follow up. J Am Coll Cardiol 1990; 16: 68. [ Links ]
13. Spittell PC, Spittell JA Jr, Joyce JW, et al. Clinical features and differential diagnosis of aortic dissection: experience with 236 cases (1980 through 1990). Mayo Clin Proc 1993; 68: 642. [ Links ]
14. Pedowitz P, Perell A. Aneurysms complicated by pregnacy. Aneurysms of the aorta and its major branches. Am J Obstet Gynecol 1957; 73: 720-735. [ Links ]
15. Hirst A, Gore I. The etiology and pathology of aortic dissection. In Doroghazi R, Slater E (eds): Aortic dissection. New York: McGraw-Hill; 1983. [ Links ]
16. Lodwick G: Dissecting aneurysms of thoracic and abdominal aorta; report of 6 cases, with discussion of roentgenologic findings and pathologic changes. Am J Roentgenol 1953; 69: 907-925. [ Links ]
17. Lui RC, Menkis AH, Mckenzie FN. Aortic dissection without intimal rupture: diagnosis and management. Ann Torac Surg 1992; 53: 886. [ Links ]
18. Burchell H. Aortic dissection (dissecting hematoma; dissecting aneurysm of the aorta). Circulation 1955; 12: 1068-1079. [ Links ]
19. Shachter N, Perloff JK, Mulder DG. Aortic dissection in Noonans syndrome. Am J Cardiol 1984; 54: 464. [ Links ]
20. Salama F, Blesovsky A. Complication of cannulation of the ascending aorta for open heart surgery. Thorax 25:604607,1970 Ref: Albat , B., and Thevenet, A.: Dissecting aneurysms of the ascending aorta occurring late alter aortic valve replacement. J. Cardiovascular Surg 1992; 33: 272. [ Links ]
21. Harris JA, Bis KG, Glover JL, et al. Penetrating atherosclerosis ulcers of the aorta. J Vas Surg 1994; 19: 90. [ Links ]
22. Muluk SC, Kaufman JA, Torchiana DF, et al. Diagnosis and treatment of thoracic aortic intramural hematoma. J Vasc Surg 1996; 24: 1022. [ Links ]
23. Lui RC, Menkis AH, Mckenzie FN. Aortic dissection without intimal rupture: diagnosis and management. Ann Torac Surg 1992; 53: 886. [ Links ]
24. Coady MA, Rizzo JA, Elefteriades JA. Pathologic variants of thoracic aortic dissections. Penetrating atherosclerotic ulcers and intramural hematomas. Cardiol Clin North Am 1999; 17: 637. [ Links ]
25. Coady MA, Rizzo JA, Hammond GL, et al. Penetrating ulcer of the thoracic aorta: What is it? How do we recognize it? How do we manage it? J Vasc Surg 1998; 27: 1006. [ Links ]
26. Muluk SC, Kaufman JA, Torchiana DF, et al. Diagnosis and treatment of thoracic aortic intramural hematoma. J Vasc Surg 1996; 24: 1022. [ Links ]
27. Slater EE, DeSanctis RW. The clinical recognition of dissecting aortic aneurysms. Am J Med 1976; 60: 625. [ Links ]
28. Fann J I, Sarris GE, Mitchell RS, et al. Treatment of patients with aortic dissection presenting with peripheral vascular complications. Ann Surg 1990; 212: 705. [ Links ]
29. Oliveira JSM, Bestetti RB, Marin-Neto JA, et al. Ruptured aortic dissection into the left atrium: a rare case of congestive heart failure. Am. Heart J 1991; 121: 936. [ Links ]
30. Roth JA, Parekh MA: Dissecting aneurysms perforating the esophagus. N Engl J Med 1978; 299: 776. [ Links ]
31. Eagle KA, Quertermous T, Kritzer GA, et al. Spectrum of conditions initially suggesting acute aortic dissection but with negative aortograms. Am J Cardiol 1986; 57: 322. [ Links ]
32. Nienaber, Christoph A. Eagle, Kim A. Aortic dissection: new frontiers in diagnosis and management: part I: from etiology to diagnostic strategies.Circulation 2003; 108; (5): 628-6355. [ Links ]
33. Jagannath AS, Sos TA, Lockhart SH, Saddekni S, Sniderman KW. Aortic dissection: a statistical analysis of the usefulness of plain chest radiographic findings. Am J Radiol 1986; 147: 1123-1126. [ Links ]
34. Luker GD, Glazer HS, Eagar G, Gutiérrez FR, Sagel SS. Aortic dissection: effect of prospective chest radiographic diagnosis on delay to definitive diagnosis. Radiology 1994; 193: 813-819. Circulation 1995; 92 (Supl 9): II107-112. [ Links ]
35. Earnest F IV, Muhm JR, Sheedy PF. Roentgenographic findings in thoracic aortic dissection. Mayo Clin Proc 1979; 54: 43. [ Links ]
36. Nicholas TK. Ouchoukos, Dougenis D, Surgery of the thoracic aorta. N Eng J Med 1997; 336; 26: 1876-1888. [ Links ]
37. Erbel R, Daniel W, Visser C, et al. Echocardiography in diagnosis of aortic dissection. Lancet 1989; 1: 457. [ Links ]
38. Victor MF, Mintz GS, Kotler MN, Wilson AR, Segal BL. Twodimensional echocardiographic diagnosis of aortic dissection. Am J Cardiol 1981; 48: 1155-1159. [ Links ]
39. Enia F, Ledda G, Lo Mauro R, et al. Utility of echocardiography in the diagnosis of aortic dissection involving the ascending aorta. Chest 1989; 95: 124. [ Links ]
40. Bryan AJ, Barzilai B, Kouchoukos NT. Transesophageal echocardiography and adult cardiac operations. Ann Thorac Surg 1995; 59: 773-9. [ Links ]
41. Adachi H, Omoto R, Kyo S, et al. Emergency surgical intervention of acute aortic dissection with the rapid diagnosis by transesophageal echocardiography. Circulation 1991; 84: (Suppl III:III-14-III-19): 1903-14. [ Links ]
42. Ballal RS, Nanda NC, Gatewood R, et al. Usefulness of transesophageal echocardiography in assessment of aortic dissection. Circulation 1991; 84: [ Links ]
43. La Marchesina U, Bragato RM, Grimaldi A, Melzi G, Armino F, Faletra F. Posterior echocardiography windows: usefulness in clinical practice. Italian Heart J 2001; (Supl 2) :158-60. [ Links ]
44. Mark A. Creager, Daniel W, et al. Atherosclerotic vascular disease conference Writing group V: medical decision making and therapy. Circulation 2004;109: 2634-2642. [ Links ]
45. Deutsch HJ, Sechtem U, Meyer H, et al. Chronic aortic dissection: comparison of MR imaging and transesophageal echocardiography. Radiology 1994; 192: 645. [ Links ]
46. Nienaber CA, Spielmann RP, von Kodolitsch Y, et al. Diagnosis of thoracic aortic dissection: magnetic resonance imaging versus transesophageal echocardiography. Circulation 1992; 85: 434. [ Links ]
47. Chirilo F, Cavallini C, Longhini C, et al. Comparative diagnostic value of transesophageal echocardiography and retrograde aortography in the evaluation of thoracic aortic dissection. Am J Cardiol 1994; 74: 590. [ Links ]
48. Nikolic G, Draganic M, Pervulov S, Jablanov J, Duknic M, Kamenica S. Ultrasound, computer tomography and angiography in the diagnosis of dissecting aortic aneurysm. Vojnosanitetski Pregled 1992; 49(6): 533-7. [ Links ]
49. Ballal RJ, Nanda NC, Gatewood R, DArcy B, Samdarshi TE, Holman WL, et al. Usefulness of transesophageal echocardiography in assessment of aortic dissection. Circulation 1991; 84: 1903-1914. [ Links ]
50. Adachi H, Omoto R, Kyo S, et al. Emergency surgical intervention of acute aortic dissection with the rapid diagnosis by transesophageal echocardiography. Circulation 1991; 84: (Suppl:III-14-III-19). [ Links ]
51. Nienaber CA, von Kodolitsch Y, Nicolas V, et al. The diagnosis of thoracic aortic dissection by noninvasive imaging procedures. N Engl J Med 1993; 328: 1-9. [ Links ]
52. Cigarroa JE, Isselbacher FM, De Sanetis RW, et al. Diagnostic imaging in the evaluation of suspected aortic dissection: old standards and new directions. N Engl J Med 1993; 328: 35-43. [ Links ]
53. Stashuk GA. Platonova AG. Computed tomography in the diagnosis of complicated abdominal aortic aneurysms. Vestnik Rentgenologii i Radiologii 2003; (3): 34-9. [ Links ]
54. Nienaber CA, von Kodolitsch Y, Brockhoff CJ, et al. Comparison of conventional and transesophageal echocardiography with magnetic resonance imaging for anatomical mapping of thoracic aortic dissection: a dual noninvasive imaging study with anatomical and/or angiographic validation. Int J Imaging 1994; 10: 1. [ Links ]
55. Rubin GD. MDCT imaging of the aorta and peripheral vessels. Eur J Radiol 2003; 45 (Suppl): S42-S49. [ Links ]
56. Sharma U, Ghai S, Paul SB, Gulati MS, Bahl VK, Rajani M, Mukhopadhyay S. Helical CT evaluation of aortic aneurysms and dissection: a pictorial essay. Clinical Imaging. 2003; 27(4): 273-80. [ Links ]
57. Panting JR, Norell MS, Baker C, Nicholson AA. Feasibility, accuracy and safety of magnetic resonance imaging in acute aortic dissection. Clin Radiol 1995; 50: 455-458. [ Links ]
58. Moore EH, Webb WR, Verrier ED, et al. MRI of chronic posttraumatic false aneurysms of the thoracic aorta. AJR Am J Roentgenol 1984; 143: 1195-6. [ Links ]
59. Chung JW, Park JH, Kim HC, et al. Entry tears of thoracic aortic dissections: MR appearance on gated SE imaging. J Comput Assist Tomogr 1994; 18: 250. [ Links ]
60. Link KM, Loehr SP, Baker DM, Lesko NM. Magnetic resonance imaging of the thoracic aorta. Semin Ultrasound CT MR 1993;14:91- 105. [ Links ]
61. Hartnell GG, Finn JP, Zenni M, et al. MR imaging of the thoracic aorta: comparison of spin-echo, angiographic, and breath-hold techniques. Radiology 1994; 191: 697-704. [ Links ]
62. Yang PC, Kerr AB, Liu AC et al. New real-time interactive cardiac magnetic resonance imaging system complements echocardiography. J Am Coll Cardiol 1998; 32: 2049-56. [ Links ]
63. Honda T, Hamada M, Matsumoto Y, Matsouka H, Hiwada K. Diagnosis of thrombus and blood flow in aortic aneurysm using tagging cine magnetic resonance imaging. Int J Angiol 1999; 8: 57-61. [ Links ]
64. Van Rossum AC, Post JC, Visser CA. Coronary imaging using MRI. Herz 1996; 21: 97-105. [ Links ]
65. Dinsmore RE, Rourke JA, DeSanctis RW, Harthorne JW, Austen WG. Angiographic findings in dissecting aortic aneurysm. N Engl J Med 1966; 275: 1152-7. [ Links ]
66. Spittell JA Jr. Clinical aspects of aneurysmal disease. Curr Probl Cardiol 1980;5:1. Iliceto S, Ettore G, Francisco G, Antonelli G, Biasco G, Rizzon P. Diagnosis of aneurysm of the thoracic aorta. Comparison between two non invasive techniques: twodimensional echocardiography and computed tomography. Eur Heart J 1984; 5: 545-55. [ Links ]
67. Williams DM, Lee DY, Hamilton BH et al. The dissected aorta: part III. Anatomy and radiologic diagnosis of branch vessel compromise. Radiology 1997; 203: 37-44. [ Links ]
68. Tomiguchi S, Morishita S, Nakashima R, Hara M, Oyama Y, Kojima A, et al. Usefulness of turboFLASH dynamic MR imaging of dissecting aneurysms of the thoracic aorta. Cardiovasc Intervent Radiol 1994; 17: 17-21. [ Links ]
69. Mendelson DS, Apter S, Mitty HA, Gendal ES, Janus CL, Ergin MA, et al. Residual dissection of the thoracic aorta after repair: MRI-angiographic correlation. Comput Med Imaging Graph 1991; 15: 31-35. [ Links ]
70. Khandheria BK. Aortic dissection: the last frontier. Circulation 1993; 87: 1765-8. [ Links ]
71. Creswell LL, Kouchoukos NT, Cox JL Rosenbloom M. Coronary artery disease in patients with type A aortic dissection. Ann Thorac Surg 1995; 59: 585-90. [ Links ]
72. Thorsen MK, San Dretto MA, Lawson TL, et al. Dissecting aortic aneurysms: accuracy of computed tomographic diagnosis. Radiology 1983; 148: 773-777. [ Links ]
73. Yamada E, Matsumura M, Kyo S, Omoto R. Usefulness of a prototype intravascular ultrasound imaging in evaluation of aortic dissection and comparisson with angiographic study, transesophageal echocardiography, computed tomography, and magnetic resonance imaging. Am J Cardiol 1995; 75: 161-5. [ Links ]
74. Koschyk DH, Meinertz T, Hofmann T, Kodolitsch YV, Dieckmann C, Wolf W, et al. Value of intravascular ultrasound for endovascular stent-graft placement in aortic dissection and aneurysm. J Cardiac Surg 2003; 18 (5): 471-7. [ Links ]
75. Jiang JH, Wang YQ, Guo DQ, Fu WG, Chen B, Yang J. The application of intravascular ultrasound imaging in identifying the visceral artery in aortic dissection. Chung-Hua i Hsueh Tsa Chih [Chinese Medical Journal] 2003; 83 (18):1580-2. [ Links ]
76. Tagle KA, DeSanctis RW. Aortic dissection. Curr Probl Cardiol 1989; 14: 225. [ Links ]
77. Miller DC, Mitchell RS, Oyer PE, et al. Independent determinants of operative mortality for patients with aortic dissection. Circulation 1987; 70(suppl I): 153. [ Links ]
78. Schor JS, Yerlioglu E, Galla JD, et al. Selective management of acute type b aortic dissection: long-term follow-up. Ann Thorac Surg 1996; 61: 1339. [ Links ]
79. Fann JI, Sarris GE, Mithell RS, et al. Treatment of patients with aortic dissection presenting with peripheral vascular complications. Ann Surg 1990; 212: 705. [ Links ]
80. Lauterback SR, Cambria RP, Brewster DC, et al. Contemporary management of aortic branch compromise resulting from acute aortic dissection. J Vasc Surg 2001; 33: 1185. [ Links ]
81. Miller DC, Mitchell RS, Oyer PE, et al. Independent determinants of operative mortality for patients with aortic dissection. Circulation 1987; 70 (suppl I): 153. [ Links ]
82. Miller D, Stinson E, Oyer P, et al. Operative treatment of aortic dissections: experience with 125 patients over a sixteen year period. J Thorac Cardiovasc Surg 1979; 78: 365 -382. [ Links ]
83. Doroghazi RM, Slater EE, DeSanctis RW, et al: long-term survival of patients with treated aortic dissections. J Am Coll Cardio 1984; 3: 1026. [ Links ]
84. Elefteriades JA, Lovoulos CJ, Coady MA, et al: Management of descending aortic dissection. Ann Torac Surg 1999; 67: 2002. [ Links ]
85. Erbel R, Alfonso F, Boileau C, et al. Diagnosis and management of aortic dissection. Recommendations of Task Force on aortic dissection, European Society of Cardiology. Eur Heart J 2001; 22: 1642-81. [ Links ]
86. Razavi Mk, Nishimura E, Slonim S, et al. Percutaneous creation of acute type B aortic dissection: an experimental model for endoluminal therapy. J Vasc Inter Radiol 1996; 9: 626. [ Links ]
87. Kato N, Hirano T, Shimono T, et al. Treatment of chronic aortic dissection by transluminal endovascular stent-graft placement: preliminary results. J Vasc Interv Radiol 2001; 12: 835. [ Links ]
88. Won JY, Lee DY, Shim WH, et al. Elective endovascular treatment of descending thoracic aortic aneurysms and chronic dissections with stent-grafts. J Vas Interv Radiol 2001; 12: 575. [ Links ]
89. Dake MD, Kato NK, Mitchell RS, et al. Endovascular stent-graft placement for the treatment of acute aortic dissection. N Engl J Med 1999; 340: 1546. [ Links ]
90. Kato N, Shimono T, Hirano T, et al: Transluminal placement of endovascular stent grafts for the treatment of type A aortic dissection with an entry tear in the descending thoracic aortic. J Vasc Surg 2001; 34:1023. [ Links ]
91. Kazui T, Tamiya Y, Tanaka T, Komatsu S. Extended aortic replacement for acute type A dissection with the tear in the descending aorta. J Torac Cardiovasc Surg 1996; 112: 973. [ Links ]
92. Evangelista A, Domínguez R, Sebastia C, Salas A, et al. Prognostic value of clinical and morphologic findings in short-term evolution of aortic intramural haematoma. Therapeutic implications. Eur Heart J (2004); 25: 81-87. [ Links ]
93. Granaha F, Miller DC, Sugimoto K, et al. Prognosis of aortic intramural hematoma with and without penetrating atherosclerotic ulcer: a clinical and radiological análisis. Circulation 2002; 106: 342-348. [ Links ]
94. Dake MD, Kato NK, Mitchell RS, et al. Endovascular stent-graft placement for the treatment of acute aortic dissection. N Engl J Med 1999;340:1546 [ Links ]
95. Ergin MA, Phillips RA, Galla JD, et al. Significance of distal false lumen alter type A dissection repair. Ann Torac Surg 1994; 57: 820. [ Links ]
96. Pitton MB, Schmiedt W, Neufang A et al. Emergency Endovascular treatment of acute aortic disease. Fortschr Rontgenstr 2002; 174 :593-9. [ Links ]
97. Alric P, Berthet JP, Branchereau P et al. Endovascular repair for acute rupture of the descending thoracic aorta. J. Endovasc Ther 2002; 9: II-51-9. [ Links ]
98. Scheinert D, Krankenberg H, Schmidt A, et al. Endoluminal stent- graft placement for acute rupture of the descending thoracic aorta. Eur Heart J 2004; 25: 694-700. [ Links ]
99. Moffatt SD, Mitchell RS. Endovascular stent management of thoracic aneurysms and dissections. In: Cohn LH, Edmundo LH Jr, eds. Cardiac Surgery in the Adult. New York.: McGraw-Hill; 2003. p. 1191-1204. [ Links ]
100. Mitchell RS: Endovascular solution for diseases of the thoracic aorta. Cardiol Clin North Am 1999; 17: 815. [ Links ]
101. Fann JI, Miller DC: Endovascular treatment of descending thoracic aortic aneurysms and dissection. Surg Clin North Am 1999; 79: 551. [ Links ]
102. Inoue K, Sato M, Iwase T, et al. Clinical endovascular placement of branched graft for type B aortic dissection. J Thorac Cardiovasc Surg 1996; 112: 1111. [ Links ]
103. Blum U, Voshage G, Lamer J, Beyersdorf F, et al. Endoluminal stent-grafts for infrarenal abdominal aortic aneurysms. N Engl J Med 1997; 336: 13. [ Links ]
104. Kusagawa H, et al. Changes in false lumen after transluminal stent-graft placement in aortic dissections six years experience. Circulation 2005; 111: 2951-2957. [ Links ]
105. Blankensteijn JD, et al. Two-year outcomes after conventional or endovascular repair of abdominal aortic aneurysms. N Engl J Med 2005; 352: 2398-405. [ Links ]