Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Colombiana de Química
versión impresa ISSN 0120-2804versión On-line ISSN 2357-3791
Rev.Colomb.Quim. v.39 n.2 Bogotá mayo/ago. 2010
MODIFICACIÓN DE LAS CARACTERÍSTICAS QUÍMICAS SUPERFICIALES DE AEROGELES DE CARBONO POR TRATAMIENTOS OXIDATIVOS
MODIFICATION OF THE CHEMISTRY SURFACE CHARACTERISTICS OF CARBON AEROGELS BY OXIDATIVE TREATMENTS
MODIFICAÇÃO DE CARACTERÍSTICAS QUÍMICAS SUPERFICIAIS DE AEROGELS DE CARBONO POR TRATAMENTOS OXIDATIVOS
Astrid R. Moreno1, Nelson O. Briceño1,2, José de J. Díaz1
1 Departamento de Química, Facultad de Ciencias, Universidad Nacional de Colombia, sede Bogotá, Carrera 30 No. 45-03, Bogotá, Colombia.
Recibido: 05/04/10 - Aceptado: 30/08/10
RESUMEN
Se prepararon aerogeles de carbono por la carbonización de aerogeles orgánicos sintetizados por el método sol-gel a partir de formaldehído, resorcinol y un catalizador básico; se modificó su superficie por tratamientos con oxígeno (8,8% en nitrógeno) y ácido nítrico. Los materiales se caracterizaron por isotermas de adsorción con nitrógeno a 77 K, descomposición con temperatura programada (DTP) de CO y CO2, punto de carga cero y punto isoeléctrico. Se encontró que los aerogeles modificados presentan micro y mesoporosidad bien desarrollada. Los resultados obtenidos por DTP muestran que la oxidación con oxígeno incrementa la concentración de grupos hidroxilo y carbonilo en la superficie de los aerogeles, mientras que la oxidación con ácido nítrico incrementa la concentración de grupos carboxilo.
Palabras clave: aerogeles de carbono, tratamientos oxidativos, química superficial.
ABSTRACT
Carbon aerogels were prepared by carbonization of organic gels synthesized by the sol-gel methodology from resorcinol, formaldehyde and a basic catalyst. Its surface was modified by treatments with oxygen (8.8% in N2) and nitric acid. The materials were characterized by nitrogen adsorption isotherms at 77 K, temperature programmed decomposition of CO and CO2 (TPD), zero charge point and isoeletric point. It was found that the modified aerogels have a well developed micro and mesoporosity; the TPD results shows that oxidative treatment with oxygen increase the concentration of hydroxyl and carbonyl groups on the surface of aerogels, whereas the oxidation with nitric acid increase the concentration of carboxyl groups.
Key words: carbon aerogels, oxidative treatments, surface chemistry.
RESUMO
Foram preparados aerogels de carbono pela carbonização dos geles orgânicos sintetizados pela metodologia sol-gel de resorcinol, de formaldeído e de um catalisador básico. A sua superfície foi modificada por tratamentos com oxigénio (8.8% em nitrogénio) e ácido nítrico. Os materiais foram caracterizados por isotermas de adsorção de nitrogénio a 77 K, pela decomposição com temperatura programada de CO e de CO2 (DTP), pelos pontos de carga zero e pelo ponto isoeléctrico. Encontrou-se que os aerogels modificados apresentaram micro e mesoporosidade bem desarrolhadas. Os resultados obtidos por DTP mostraram que a oxidação com oxigénio aumenta a concentração de grupos hidroxilo e carbonilo na superfície dos aerogels, enquanto que a oxidação com ácido nítrico aumenta a concentração de grupos carboxilo.
Palavras-chave: aerogels do carbono, tratamentos oxidativos, química de superfície.
INTRODUCCIÓN
Los aerogeles de carbono son materiales novedosos que han recibido atención especial en los últimos años (1-4). Se obtienen a partir de la policondensación sol-gel de algunos monómeros orgánicos, tales como resorcinol y formaldehído, y su posterior carbonización. La estructura porosa resultante está formada por una red polimérica interconectada a escala nanométrica, semejante a la estructura de un coral, con diámetros de poro en el rango de 0 a 20 nm (5). Este tipo de conformación es responsable de la micro y mesoporosidad (6), el desarrollo del área superficial (entre 400 y 900 m2/g) y la baja densidad del material (del orden de 0,03 g/cm3) (7), características que los hacen prometedores para su aplicación como adsorbentes (8) y soportes para catalizadores (3, 9).
En el presente trabajo se sintetizaron aerogeles de carbono siguiendo el método propuesto por Pekala (10). Primero se produce la polimerización del gel orgánico por la mezcla de resorcinol con formaldehído en presencia de un catalizador básico en disolución acuosa; la segunda etapa comprende el proceso de curado al someter al gel a un tratamiento térmico, seguido de un intercambio del solvente inicial (H2O) por un solvente orgánico, con el fin de favorecer la tercera etapa donde se da el secado con CO2 a condiciones supercríticas (31 K y 7,4 MPa) para eliminar el disolvente, buscando suprimir la formación del menisco entre las dos fases (líquido-vapor), minimizando la tensión y consiguiendo dejar vacío el espacio entre las partículas que dará lugar a la meso y macroporosidad (11-13), obteniéndose el aerogel orgánico. La última etapa consiste en la carbonización del aerogel orgánico, donde se somete a un tratamiento térmico en atmósfera inerte (usualmente nitrógeno) a temperaturas inferiores a los 1.073 K. En este tratamiento se busca eliminar el contenido de materia volátil del precursor, disminuir su densidad y aumentar el contenido de carbono, generando un incremento en el número de micro y mesoporos, lo que conduce a un aumento en el área superficial (14). Las condiciones de esta etapa influyen en la calidad y en el rendimiento del material obtenido.
La naturaleza y la cantidad de los grupos superficiales pueden modificarse por diferentes tratamientos que inducen cambios texturales y de química superficial (15-17). Para evaluar estas modificaciones se realizaron tratamientos en fase líquida mediante el uso de HNO3 (17) y en fase gaseosa con oxígeno diluido (18). Los materiales se caracterizaron por diferentes técnicas.
MATERIALES Y MÉTODOS Materiales
Se utilizaron los siguientes reactivos para la síntesis de los geles orgánicos: resorcinol Panreac 99,0-100,5% (R), formaldehído Chemi 35-37% en agua (F), agua desionizada (W) y como catalizador K2CO3 Carlo Erba 99,9% (Cat).
Preparación
Para la preparación de los geles orgánicos se emplearon las relaciones molares R/F = 0,5; R/Cat = 800 y R/W = 7,32 x 10-3. La mezcla se agitó hasta obtener una disolución homogénea, se midió el pH y luego se vertió en tubos de vidrio (45 cm de largo x 0,5 cm de diámetro). La gelificación se realizó en un baño termostatado controlando la temperatura a 298 K por 1 día, 323 K por 2 días y 353 K por 5 días. Completado el proceso de gelificación, las barras de gel obtenidas se retiraron de los tubos, se cortaron en cilindros de 0,5 cm de longitud y se colocaron en acetona para retirar el agua usada como solvente.
El secado de los geles orgánicos se realizó en un sistema de reacción como se describe en la literatura (19). El CO2 líquido se pasó por un intercambiador de calor para estabilizar su temperatura a 276 K, y mediante una bomba Lewa EK-1(Lewa GmbH) se inyectó a un reactor Parr, modelo 4575 (Parr Instrument Company) apropiado para trabajo a altas presiones, hasta alcanzar una presión de 7,2 MPa; estas condiciones se mantuvieron por 4 horas y se repitió el procedimiento durante 4 días para eliminar la mayor cantidad de acetona. Pasado este tiempo, con ayuda de un baño termostatado, se incrementó la temperatura para llegar a la condición supercrítica del CO2 (304 K, 7,2 MPa). La acetona remanente se extrajo durante 1 hora. Finalmente se despresurizó el sistema y se obtuvo el aerogel orgánico (AO).
Los aerogeles orgánicos se carbonizaron en un reactor de cuarzo dentro de un horno tubular en atmósfera de nitrógeno con un flujo de 100 cm3/min. El sistema se calentó a 2 K/min hasta alcanzar una temperatura de 1.023 K donde se mantuvo por 5 horas, dando lugar a los aerogeles de carbono (AC).
Modificación
Los aerogeles de carbono fueron modificados por tratamientos en fase gaseosa y fase líquida, con el fin de obtener diferentes características superficiales. Para la oxidación en fase gaseosa se empleó O2 al 8,8% en nitrógeno. Se cargaron 2,5 g de muestra en un reactor de cuarzo dentro de un horno vertical. Se llevaron a 698Kdurante 10 horas, bajo un flujo constante de 250 mL/min y una velocidad de calentamiento de 10 K/min de la mezcla gaseosa. Las muestras obtenidas se identificaron como ACO. Para la oxidación en fase líquida, las muestras se colocaron en un sistema de reflujo durante 6 horas en relación de 1 g de muestra por 10 mL de ácido. Una vez transcurrido el tiempo se hicieron lavados de las muestras hasta obtener pH constante. Se dejaron durante 24 horas a 383 K. Las muestras obtenidas se identificaron como ACH.
Caracterización
La caracterización textural de los aerogeles modificados y sin modificar se realizó por isotermas de adsorción de nitrógeno a 77 K en un equipo Micrometrics Gemini 2375. A partir de estas isotermas se determinó el área superficial por el modelo BET y las características texturales por Dubinin-Radushkevich. El ancho medio de microporos se estableció por la ecuación de Stoeckli mediante la energía característica de adsorción (11, 14). El área específica equivalente se determinó de acuerdo con el método propuesto por Gregg y Sing (20).
Los espectros DTP de CO y CO2 se obtuvieron en un equipo de reacción y ensayos catalíticos como se describe en la literatura (17). El equipo consta de un horno vertical que puede operar a 1.473 K, un controlador de temperatura, un reactor de cuarzo en forma de U con una frita porosa en uno de sus brazos para soportar la muestra y controladores de flujo másico que permiten regular el flujo de gases que se inyectan al sistema (inerte, reactivo y oxidante). La detección del CO y del CO2 desprendidos por las muestras se realizó con ayuda de un cromatógrafo Hewlett Packard 6890 con detector de conductividad térmica (DCT) y una columna HP Plot-Q . Para el análisis se utilizaron 200 mg de muestra, se empleó helio como gas de arrastre, con un flujo de 22,5 mL/min y se ajustó una velocidad de calentamiento de 5 K/min desde temperatura ambiente hasta 1.373 K (17).
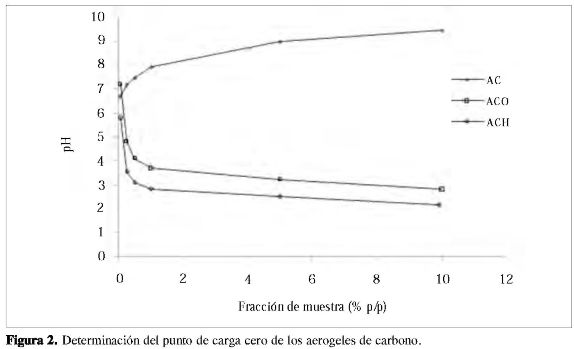
Para la determinación del punto de carga cero, se prepararon mezclas de la muestra con solución de KNO3 0,03 M en proporción de 0,05, 0,25, 0,50, 1,00, 5,00 y 10,00% en peso, y se colocaron en recipientes plásticos de cierre hermético. Las mezclas se saturaron con nitrógeno para eliminar el CO2 atmosférico y se dejaron en agitación 24 horas a 298 K; completado el tiempo de agitación, se midió el pH de cada una de las mezclas. El punto de carga cero se determinó como el máximo al cual tiende la curva de pH en función de la concentración de la muestra en la suspensión (17, 21).
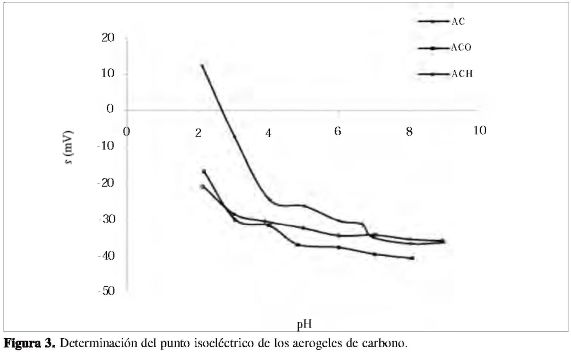
Para la determinación del punto isoeléctrico, las muestras se pulverizaron a un tamaño de partícula inferior a malla 325 (>45 µm). Se prepararon suspensiones pesando 0,025 g de muestra en 250 mL de solución de KNO3 0,001M; las suspensiones se saturaron con nitrógeno y se dejaron en agitación a 298 K por 24 horas. Para ajustar el pH de cada medida, la solución se dividió en dos partes iguales; a una se adicionó HCl y a la otra NaOH. La medición de cada punto se tomó como el promedio de 10 medidas, y el punto isoeléctrico se determinó como el pH en el cual el potencial zeta es cero, en el equipo Zeta-Meter System 3,0+ (17, 22).
RESULTADOS Y DISCUSIÓN
Durante el proceso de curado de los geles se evidenció un cambio progresivo en la coloración, pasando de incolora a un tono amarillo, naranja y finalmente rojo oscuro en función del tiempo de reacción. Este cambio de color es una evidencia del curso de la reacción de polimerización. El pH trabajado fue de 6,12, el cual está dentro del intervalo reportado como óptimo para obtener las características finales deseadas de los aerogeles.
Caracterización textural
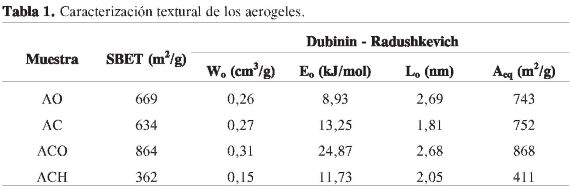
En la Tabla 1 se recopila la información del procesamiento de los datos obtenidos de las isotermas. El aerogel orgánico muestra un área superficial de 669 m2/g, que está asociada con un buen volumen de microporo; al carbonizarse se nota una ligera disminución en el área superficial, con un leve aumento en el volumen de microporo. Este hecho indica que las características texturales del aerogel orgánico se mantienen con el proceso de carbonización.
Los tratamientos oxidativos producen cambios en la textura de los materiales. El tratamiento con oxígeno diluido exhibe las mayores variaciones en las características texturales favoreciendo principalmente el desarrollo de microporosidad. Este hecho puede deberse a que el tratamiento se considera como una etapa de activación moderada, en la cual ocurre una gasificación y remoción de parte de la matriz carbonosa por efecto de la oxidación, lo que genera a su vez una disminución en la densidad aparente del material y una pérdida de peso en el tratamiento realizado. El tratamiento con ácido nítrico genera una disminución en la capacidad de adsorción a presiones relativas bajas, que se traduce como una disminución del área y volumen de microporo y un aumento en el ancho promedio de microporo, respecto a AC, lo cual indica que este tratamiento tiende a favorecer el desarrollo de mesoporosidad a expensas de la microporosidad existente. Esta reducción se causa por la acción conjunta del colapso de las paredes de los microporos producida por la oxidación, que genera grupos oxigenados terminales, que a su vez bloquean parcialmente la entrada a los microporos (11), y por la destrucción mecánica de los poros debido a la tensión superficial de la solución oxidante (22).
En general, se puede decir que la distribución del ancho promedio de poro para los aerogeles se encuentra entre 1,81 y 2,69 nm, indicando que los materiales son principalmente microporosos. La energía de adsorción característica se afecta con los tratamientos oxidativos, es decir que está asociado con el desarrollo de la porosidad. Para el caso de la muestra AO, se observa una disminución en Eo, debido a que presenta la mayor meso-porosidad.
Análisis elemental
En la Tabla 2 se reportan los resultados del análisis elemental de las muestras realizado de acuerdo con la norma ASTM D5373 (23). Se observa que las muestras ACO y ACH presentan una disminución en el contenido de carbono respecto a AC, mientras que se da un aumento del contenido de oxígeno en la muestra ACH respecto a ACO, lo cual indica que se obtiene una mayor incorporación de oxígeno como grupos superficiales oxigenados durante el tratamiento con ácido nítrico. Además, se observa un aumento en el contenido de nitrógeno, atribuido a la capacidad del ácido nítrico para nitrar los anillos aromáticos en la superficie del material (24).
Desorción con temperatura programada
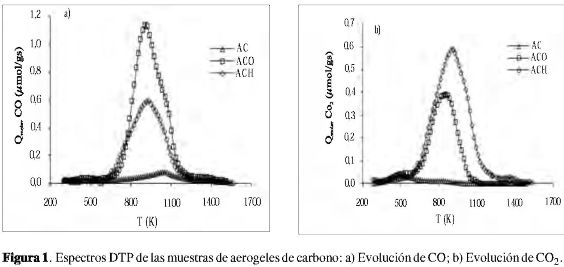
En la Figura 1 se muestran los perfiles de evolución de monóxido y dióxido de carbono para los aerogeles de carbono. Se observa que los tratamientos oxidativos incrementan el contenido de grupos funcionales oxigenados, dando lugar al aumento en la evolución de CO y CO2. El aerogel de carbono no muestra rasgos espectrales significativos de evolución de CO y CO2, debido a los bajos contenidos de grupos superficiales que posee. Se advierte que la muestra tratada con ácido nítrico presenta una mayor liberación de CO y CO2, indicando una mayor cantidad de grupos superficiales oxigenados. La muestra tratada con oxígeno desarrolla preferencialmente grupos funcionales que se descomponen en forma de CO.
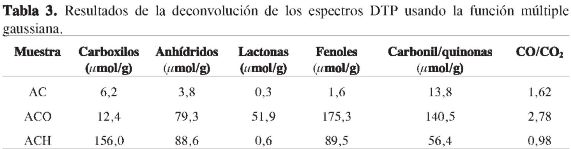
Para la interpretación de las diferentes señales se relacionó la temperatura de descomposición de cada grupo con los picos u hombros de acuerdo con lo propuesto por Figueiredo y colaboradores (15) donde el perfil de CO2 resulta de la descomposición de grupos ácido carboxílico a temperaturas bajas (< 700 K) y lactona a temperaturas altas (~ 940 K), además de los anhídridos carboxílico que evolucionan a CO y CO2 (~ 820 K). El perfil de evolución de CO aparece por la descomposición de grupos fenol (~ 905 K) y carbonil/quinonas (~ 1.080 K) (15). En la Tabla 3 se presentan los resultados obtenidos de la deconvolución de los espectros DTP. Se muestra que existe una contribución de los diferentes grupos superficiales, que se incrementa en uno u otro grupo por el tipo de tratamiento realizado. Se observa que los grupos carboxilo se favorecen principalmente en la muestra tratada con ácido nítrico, seguidos de fenol y anhídrido, en tanto que la muestra tratada con oxígeno presenta mayores cantidades de grupos fenol, carbonil/quinona y, en menor grado, anhídrido. Para la muestra sin tratar se detectan cantidades muy pequeñas de los grupos superficiales estudiados, lo cual indica que el proceso de carbonización en atmósfera inerte no genera química superficial apreciable. La baja relación de CO/CO2 obtenida con el ácido nítrico se asocia con un aumento en la acidez del aerogel ACH, en tanto que la relación CO/CO2 obtenida con oxígeno es superior a la muestra tratada en ácido nítrico, lo cual está asociado con una menor acidez en el material. Aunque la muestra del aerogel de carbono presenta poca cantidad de grupos superficiales, su carácter ácido es intermedio entre los materiales tratados.
Distribución de carga superficial
En la Figura 2 se presentan las gráficas obtenidas en la determinación del punto de carga cero de las muestras de aerogeles de carbono. Las modificaciones por los tratamientos oxidativos generan un material de carácter ácido, indicando un alto contenido de grupos superficiales oxigenados, como se infirió del análisis por DTP, en tanto que el aerogel de carbono muestra un PCC ligeramente básico.
En la Figura 3 se grafican los resultados de las medidas obtenidas en la determinación del punto isoeléctrico. Las muestras tratadas con ácido nítrico y oxígeno diluido presentan puntos isoeléctricos muy bajos y menores a los puntos de carga cero, en tanto que el aerogel de carbono muestra un PIE de 2,70.
Al comparar los diferentes tratamientos, se observa una disminución del PIE de las muestras ACO y ACH respecto al aerogel de carbono, lo cual puede atribuirse a la introducción de grupos superficiales más ácidos que se localizan en aristas de la superficie externa de los materiales (15). El pH del aerogel de carbono disminuye a medida que aumenta el grado de oxidación de la muestra.
La diferencia entre el punto de carga cero y el punto isoeléctrico refleja el hecho de que más grupos acídicos se introducen en la superficie de los materiales, observándose una oxidación preferencial externa, acompañada de mayor acidez, hecho que se confirma con la relación CO/CO2 obtenida con los DTP. El mayor valor del PIE en el tratamiento con oxígeno con respecto al tratamiento con ácido nítrico puede explicarse por la temperatura del tratamiento (> 673 K), dado que a estas condiciones pueden eliminarse algunos grupos carboxilo de la superficie del material.
CONCLUSIONES
Los tratamientos oxidativos empleados para la modificación de la química superficial de los aerogeles de carbono producen un aumento en el contenido de grupos oxigenados en la superficie del material. El tratamiento con ácido nítrico concentrado favorece la formación de grupos tipo ácido carboxílico, en tanto que el tratamiento con oxígeno diluido al 8,8% en nitrógeno a 698 K favorece la formación de grupos de carácter menos ácido, fenoles y carbonilos, lo cual se confirma con las medidas de PCC, PIE y pH de la suspensión. Las propiedades texturales del aerogel orgánico precursor del aerogel de carbono no se afectan apreciablemente, mientras que los tratamientos oxidativos ocasionan modificaciones texturales significativas, donde el tratamiento con oxígeno diluido desarrolla mayor microporosidad y, por ende, mayor área superficial, en tanto que el tratamiento con ácido nítrico produce una disminución de la microporosidad y del área superficial.
AGRADECIMIENTOS
Los autores expresan su agradecimiento a la DIB, por el patrocinio a esta investigación a través del proyecto "Preparación de catalizadores soportados en aerogeles de carbono para la síntesis F-T", Código Quipu 201010013227.
REFERENCIAS BIBLIOGRÁFICAS
1. Sánchez-Polo, M.; Rivera-Utrilla, J.; Méndez-Díaz, J.; López-Peñalver, J. Metal-Doped Carbon Aerogels. New Materials for Water Treatments. Industrial & Engineering Chemistry Research. 2008. 47 (16): 6001-6005. [ Links ]
2. Lee, Y. J.; Jung, J. C.; Park, S.; Seo, J. G.; Baeck, S.-H.; Yoon, J. R.; Yi, J.; Song, I. K. Preparation and characterization of metal-doped carbon aerogel for supercapacitor. Current Applied Physics. 2010. 10 (3): 947-951. [ Links ]
3. Moreno-Castilla, C.; Maldonado-Hódar, F. J. Carbon aerogels for catalysis applications: An overview. Carbon. 2005. 43 (3): 455-465. [ Links ]
4. Zhang, L.; Liu, H.; Wang, M.; Liu, W. Carbon aerogels for electric double-layer capacitors. Rare Metals. 2006. 25 (6, Supplement 1): 51-57. [ Links ]
5. Yoshizawa, N.; Hatori, H.; Soneda, Y.; Hanzawa, Y.; Kaneko, K.; Dresselhaus, M. S. Structure and electrochemical properties ofcarbon aerogels polymerized in the presence of Cu2+. Journal of Non-Crystalline Solids. 2003. 330 (1-3): 99-105. [ Links ]
6. Schaefer, D. W.; Pekala, R.; Beau-cage, G. Origin of porosity in resor-cinol-formaldehyde aerogels. Journal ofNon-Crystalline Solids. 1995. 186: 159-167. [ Links ]
7. Wu, D.; Fu, R.; Sun, Z.; Yu, Z. Low-density organic and carbon aerogels from the sol-gel polymerization of phenol with formaldehyde. Journal of Non-Crystalline Solids. 2005. 351 (10-11): 915-921. [ Links ]
8. Fairén-Jiménez, D.; Carrasco-Marín, F.; Moreno-Castilla, C. Adsorption of Benzene, Toluene, and Xyle-nes on Monolithic Carbon Aerogels from Dry Air Flows. Langmuir. 2007.23(20): 10095-10101. [ Links ]
9. Maldonado-Hódar, F. J.; Pérez-Cadenas, A. F.; Moreno-Castilla, C. Morphology ofheat-treated tunsgten doped monolithic carbon aerogels. Carbon. 2003. 41 (6): 1291-1299. [ Links ]
10. Pekala, R. W. Organic aerogels from the polycondensation of resorcinol with formaldehyde. Journal of Materials Science. 1989. 24 (9): 3221-3227. [ Links ]
11. Pekala, R. W.; Schaefer, D. W. Structure of organic aerogels. 1. Morphology and scaling. Macromolecules. 1993. 26 (20): 5487-5493. [ Links ]
12. Rodríguez-Reinoso, F.; Molina-Sabio, M. Textural and chemical characterization of microporous carbons. Advances in Colloid and Interface Science. 1998. 76-77: 271-294. [ Links ]
13. Gesser, H. D.; Goswami, P. C. Aerogels and related porous materials. Chemical Reviews. 1989. 89 (4): 765-788. [ Links ]
14. Pierre, A. C.; Pajonk, G. M. Chemistry of Aerogels and Their Applications. Chemical Reviews. 2002. 102 (11): 4243-4266. [ Links ]
15. Figueiredo, J. L.; Pereira, M. F. R.; Freitas, M. M. A.; Orfao, J. J. M. Modification of the surface chemistry of activated carbons. Carbon. 1999. 37 (9): 1379-1389. [ Links ]
16. Figueiredo, J. L.; Pereira, M. F. R.; Freitas, M. M. A.; Órfão, J. J. M. Characterization of active sites on carbon catalysts. Industrial and Engineering Chemistry Research. 2007. 46(12): 4110-4115. [ Links ]
17. Briceño, Nelson O.; Guzmán, Martha Y.; Díaz, José de J. Grupos superficiales en materiales carbonosos. Caracterización por diferentes técnicas. Revista Colombiana de Química. 2007. 36 (1): 121-130. [ Links ]
18. Díaz Velásquez, J.; Carballo Suárez, L. M.; Figueiredo, J. L. Oxidative dehydrogenation of isobutane over activated carbon catalysts. Applied Catalysis A: General. 2006. 311: 51-57. [ Links ]
19. Pekala, R. W.; Farmer, J. C.; Alviso, C. T.; Tran, T. D.; Mayer, S. T.; Miller, J. M.; Dunn, B. Carbon aerogels for electrochemical applications. Journal of Non-Crystalline Solids. 1998. 225 (1): 74-80. [ Links ]
20. Gregg, S. J.; Sing, K. S. W. Adsorption surface area and porosity. London, Academic Press. 1982. [ Links ]
21. Noh, J. S.; Schwarz, J. A. Estimation of the point of zero charge of simple oxides by mass titration. Journal of Colloid and Interface Science. 1989. 130 (1): 157-164. [ Links ]
22. Menéndez, J. A.; Illán-Gómez, M. J.; León y León, C. A.; Radovic, L. R. On the difference between the isoelectric point and the point of zero charge of carbons. Carbon. 1995.33 (11): 1655-1657. [ Links ]
23. ASTM Standard D5373-08 in Standard Test Methods for Instrumental Determination of Carbon, Hydrogen and Nitrogen un Laboratory Samples of Coal, Vol. ASTM International, West Conshohocken, PA 19428 -2959. United States. 2008. [ Links ]
24. Barton, S. S.; Evans, M. J. B.; Halliop, E.; MacDonald, J. A. F. Acidic and basic sites on the surface of porous carbon. Carbon. 1997 . 35 (9): 1361-1366. [ Links ]