Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Entomología
Print version ISSN 0120-0488On-line version ISSN 2665-4385
Rev. Colomb. Entomol. vol.33 no.1 Bogotá Jan./June 2007
Sección Agrícola
(Coleoptera: Melolonthidae)
(Coleoptera: Melolonthidae)
ELSA LILIANA MELO-MOLINA1, CARLOS ALBERTO ORTEGA-Ojeda2, ANDREAS GAIGL3
1 E-mail de los autores para correspondencia: meloelsa@gmail.com; agaigl@unal.edu.co
2 M.Sc. Asesor comercial: Punto Química S.A. del Ecuador. caoro2003@yahoo.com, caoro2003@gmail.com.
3 Ph. D. Entomólogo, Facultad de Agronomía, Universidad Nacional de Colombia, Sede Bogotá. agaigl@unal.edu.co
Resumen. El complejo de chisas rizófagas que incluye a Phyllophaga menetriesi y Anomala inconstans afecta a un amplio rango de cultivos comerciales, generando grandes pérdidas en Colombia. Una alternativa ambientalmente sostenible para su control es el uso de nematodos entomopatógenos (NEP’s). Conociendo que algunos estados de desarrollo de las plagas son más susceptibles a estos microorganismos, se evaluó el efecto de los entomonemátodos Heterorhabditis sp. (HNICenicafé) y Steinernema feltiae (Sf-Villapinzón) sobre la mortalidad de los diferentes estados de estas dos especies de chisas [L1, L2, L3 joven, L3 madura (L3m) y Prepupa (Pp)]. Se aplicó una concentración de 10.000 IJs/ml a larvas mantenidas en suelo orgánico, en condiciones controladas de laboratorio (24,5ºC y 70 ± 5% H. R.); evaluando su efecto 10 y 20 días después de la inoculación (DDI). Los aislamientos de NEP’s causaron diferentes tasas de mortalidad para A. inconstans (P ≤ 0,05), encontrándose mayor mortalidad con HNI (84,7%) frente a Sf (76,7%), para los diferentes instares, aunque L2 fue más susceptible con el primer aislamiento (98,3%). No hubo diferencias entre épocas de evaluación para esta especie. La mayor mortalidad de P. menetriesi se presentó a los 20 DDI con el aislamiento HNI, siendo también el estado de L2 el más susceptible (81,1%). Se determinó que la susceptibilidad de las chisas a los NEP’s depende tanto de su especie como del aislamiento utilizado del entomopatógeno. Estos resultados son tan importantes como el conocimiento de la dinámica de la plaga, para poder desarrollar estrategias para el control biológico de chisas.
Palabras clave. Chisas. Entomoparásitos. Steinernema feltiae. Heterorhabditis. Control Biológico.
Abstract. The complex of rhizophagous white grubs that includes Phyllophaga menetriesi and Anomala inconstans affects a wide range of commercial crops, generating severe yield losses in Colombia. One environmentally sustainable alternative for their control is the use of entomopathogenic nematodes (EPN’s). Understanding that certain developmental stages of pests are more susceptible to these microorganisms, we studied the effects of the entomonematodes Heterorhabditis sp. (HNI-Cenicafé) and Steinernema feltiae (Sf-Villapinzón) on the mortality of different stages of these two white grubs species [L1, L2, L3 young, L3 mature (L3m) and Prepupae (Pp)]. Under controlled laboratory conditions (24.5ºC and 70 ± 5% R. H.), we applied a concentration of 10,000 IJs/ml to larvae maintained in organic soil, evaluating their effect 10 and 20 days after inoculation (DAI). The EPN strains caused different mortality rates on A. inconstans (P ≤ 0.05), with higher mortality for HNI (84.7%) than Sf (76.7%) for the different instars, although L2 was more susceptible to the first strain (98.3%). No differences were observed between evaluation times for these species. The greatest mortality in P. menetriesi occurred at 20 DAI with HNI, where L2 was also the most susceptible stage (81.1%). It was determined that the susceptibility of white grubs to EPN’s depends on the host species as well as the EPN strain used. These findings are as important as knowledge of pest dynamics in order to be able to develop strategies for the biological control of white grubs.
Key words. white grubs. Entomoparasites. Steinernema feltiae. Heterorhabditis. Biological Control.
Introducción
Las larvas de la familia Melolonthidae al igual que las de Scarabaeidae, reciben diferentes denominaciones: chisas, chizas, mojojoy (Colombia), orugas blancas o gallina ciega, orontoco, chorontoco, joboto, jogoto, chicharra, chabote (Centro América), white grub (países de habla inglesa). Del mismo modo, los nombres de los adultos están relacionados con aspectos como la época de aparición o alguna característica asociada con la especie: marceños, cucarrón de invierno (Colombia), abejón de mayo, ron ron (Centro América), may o june beetles, chafer beetle (países de habla inglesa) (Andrews 1984; King 1984; Posada 1989; Pardo-Locarno 2002).
En Colombia los ataques de chisas se han generalizado en todas las zonas agroecológicas del país, especialmente en la Región Andina, en áreas de clima frío y templado donde se encuentra agricultura de ladera. Los registros muestran 580 especies, de las cuales aproximadamente 225 son consideradas plaga; destacándose los géneros Phyllophaga, Astaena, Plectris, Anomala, Ancongnatha, Cyclocephala entre otros (Posada 1993; Morón 1995; Pardo-Locarno et al. 1995;Sánchez y Vásquez 1996; Vallejo 1997; Madrigal Sánchez y Vásquez 1996; Vallejo 1997; Madrigal 2002).
Phyllophaga sp. se presenta principalmente en Cundinamarca, Antioquia, Cauca, Nariño, Quindío, y Valle del Cauca, en cultivos como cítricos, maracuyá, café, trigo, cebada, pastos, flores, cebolla, maíz, fríjol, pimentón, papa, yuca, caña y plátano. Estos insectos poseen una gran capacidad adaptativa por lo cual se encuentran en diversos agroecosistemas que van desde el nivel del mar hasta 3.500 msnm aproximadamente y desde los Estados Unidos hasta América del Sur (Posada 1989; King y Saunder 1984; ICA 1993a, 1993b; Posada 1993; Aragón et al. 2005 ).
Aunque son escasos los datos relativos a la biología de algunas especies de estos rizófagos, el ciclo biológico de Phyllophaga sp. en yuca en Colombia dura un año (Bellotti et al. 1983). Análogamente, estudios en Phyllophaga menetriesi (Blanchard, 1850) indican que los primeros dos instares se alimentan
de materia orgánica y raíces tiernas y tienen una duración de 19 y 27 semanas para la L1 (larva) y L2, respectivamente. El tercer instar dura 175 días en promedio, este es el único estadío de importancia económica, una vez alcanzado el desarrollo completo puede alcanzar una longitud de 40 mm; son blancocrema, en forma de C, con cabeza café-amarillento, prominente y mandíbulas fuertes (King 1984; Ayala y Monterroso 1998; CIAT 2005). Posteriormente, la larva entra en un periodo de diapausa antes de convertirse en pupa, el cual dura 30 días. Previo a esta etapa, la mayoría de los contenidos del intestino han sido expulsados y los cuerpos grasos se llenan, dando a la larva una apariencia blanco-cremosa; en este período no se alimenta. En general el ciclo biológico comprende 298 días desde huevo hasta adulto (Ayala y Monterroso 1998; CIAT 2005).
Para el género Anomala, desafortunadamente, el conocimiento de la ecología y biología en los trópicos es prácticamente nulo (Ritcher 1958; King y Saunders 1984). Sin embargo, algunas investigaciones lo reportan desde el nivel del mar hasta 3.000 msnm, con los adultos de algunas especies teniendo una aparición estacional menos marcada que en Phyllophaga, mostrando dos ciclos anuales, por lo que se puede recolectar todo el año (Pardo-Locarno 2000, 2002). Su ciclo biológico, es básicamente similar al de P. menetriesi, pero más corto que en la mayoría de las especies (King 1984), específicamente el de la especie Anomala inconstans Burmeister, 1844 dura aproximadamente 249 días desde huevo hasta adulto (CIAT 2004). Pardo-Locarno (1993) encontró en colectas con trampas de luz ubicadas en San Antonio (Cauca), que algunas especies de este género aparecían esporádicamente durante todo el tiempo de muestreo y no especialmente en las épocas lluviosas.
Las larvas de Anomala se alimentan principalmente de materia orgánica en descomposición al inicio, y posteriormente de raíces de pastos, maíz, fique, tomate, café, espárragos y plantas ornamentales. Los estados de desarrollo tienen una duración así: L1: 27, L2: 29, L3: 163 días (King y Saunders 1984; Hilje 1993; Pardo-Locarno 2000; CIAT 2005). Algunas de las especies pertenecientes a este género han sido consideradas de interés en diferentes puntos del Valle del Cauca en donde las larvas se comportan como rizófagas (Pardo-Locarno 1993).
El control químico de este grupo de insectos se ha descartado por el costo económico y ambiental que representa (Robertson et al. 1970), por la dificultad de manejo debido al desconocimiento de los aspectos fundamentales de su dinámica poblacional (movilidad de las larvas en el perfil del suelo por cambios de humedad, temperatura y disponibilidad de raíces para alimento), y por el hecho que no todas las larvas son plaga, por lo cual, este método de control puede afectar tanto larvas rizófagas, saprófagas como facultativas (Falcón y Smith 1983; Ramírez et al. 2001; Rodríguez et al. 2004).
Entre los enemigos naturales de las chisas se encuentran vertebrados, insectos y microorganismos como hongos, bacterios, virus, protozoarios, microsporidios y nematodos (Marion 1941; Klein 1981; Jackson 1993; Posada 1993). Los escarabeidos han sido objeto de control microbiano por varias razones: al ser plagas del suelo, viven en un medio con temperaturas relativamente estables, con alta humedad relativa, y en general protegidos contra las condiciones extremas del ambiente; siendo este el medio natural para la mayoría de los entomopatógenos de chisas como los hongos y nematodos (Kaya 1990; Shannon 1994).
Estudios realizados por Kard et al. (1988), Villani y Wright (1988), Wright et al. (1988), Klein (1990) y Forschler y Gardner (1991), para el control de chisas tales como Popillia japonica Newman, 1841, Rhizotrogus majalis (Razoumowsky), Phyllophaga fusca (Froelich, 1792), Phyllophaga anxia (LeConte, 1850) y Polyphylla comes Casey, 1914 con diferentes especies de nematodos de las familias Steinernematidae y Heterorhabditidae hallaron que su uso es prometedor y su efectividad mayor cuando las dosis de nematodos usadas son altas; además, por la capacidad de reproducción y supervivencia de los nematodos es posible reducir el número de aplicaciones y eliminar el uso de insecticidas. A esto se añade que si se trabaja con especies nativas, estas pueden resultar más eficientes considerando que un organismo que ha compartido el mismo hábitat con la plaga tiene mayor probabilidad de ser específico en el hospedante, y que además existen mejores posibilidades de encontrar aislamientos que combinen alta virulencia con especificidad, existentes en lugares donde el hospedante está presente (Prior 1992; Shannon y Carballo 1996). La mayoría de los estudios con nematodos entomopatógenos (NEP’s), reportados nacional e internacionalmente con estos rizófagos, se han concentrado en el tercer instar (Jackson y Brooks 1995; CIAT 2004; Koppenhöffer y Fuzy 2004), por ser el más dañino y de más larga duración (King 1984).
En investigaciones realizadas en Colombia sobre larvas de P. menetriesi en L3, bajo condiciones controladas de laboratorio, se evaluaron especies de nematodos nativas e introducidas de los géneros Steinernema y Heterorhabditis obteniendo hasta el 30% de mortalidad (CIAT 2003; Quintero 2003; Melo y Gaigl 2004). Teniendo en cuenta las consideraciones anteriores, el objetivo de este trabajo es evaluar el efecto de dos aislamientos de nematodos entomopatógenos (Heterorhabditis bacteriophora Poinar, 1975 y Steinernema feltiae (Filipjev, 1934)) sobre estados larvales de Phyllophaga menetriesi y A. inconstans.
Materiales y Métodos
Este experimento se realizó en el laboratorio de entomología de yuca en el campo experimental del Centro Internacional de Agricultura Tropical - CIAT, Palmira, Colombia, bajo condiciones controladas (24,5°C y 73,5% de H. R.), en total oscuridad.
Aislamientos de NEP’s evaluadas. Se usaron dos aislamientos nativos de NEP’s, uno de la especie Steinernema feltiae (Cundinamarca-Villapinzón, J. C. Parada) y otro de Heterorhabditis bacteriophora (Tolima-Fresno, Cenicafé, J. C. López), a la concentración de 10.000 infectivos juveniles (IJs)/ml, aplicando 1 ml de la solución a cada recipiente, así como a los controles se les agregó 1 ml de agua destilada estéril (ADE). Los IJs de los NEP’s utilizados provinieron de un cultivo en laboratorio sobre larvas de Galleria mellonella (L., 1758) (Lepidoptera: Pyralidae) y se mantuvieron hasta el experimento en ADE y en incubadora (15°C) por menos de 10 días.
La mortalidad de A. inconstans se evaluó con los dos aislamientos de NEP’s para todos los estados, mientras que la de P. menetriesi, sólo se evaluó con H. bacteriophora.
Insecto blanco. Las larvas (A. inconstans y P. menetriesi) provinieron de la cría en el CIAT (23°C y 70% H. R.), a partir de adultos capturados en campo usando trampas de luz negra en el norte del Cauca (Caldono, 1.580 msnm, 18°C). Durante el estudio se alimentaron de raíces de plántulas de arroz con doce días de germinación, manteniéndolos durante el 1er instar en recipientes plásticos de cinco litros y, durante los demás estados en vasos plásticos con 70 g del sustrato suelo: tierra capote en relación 1:1.
Entre noviembre del 2004 y marzo del 2005 se usaron larvas de los estadíos: primero, segundo, tercero inicial (con dos semanas de edad), tercero maduro (seis semanas de edad) y prepupa. Estos se mantuvieron en envases plásticos con 28 g del sustrato esterilizado con vapor húmedo, temperatura de 70 a 80°C por dos horas, a capacidad de campo y alimentadas de la misma dieta que en la cría.
Diseño experimental. Se trabajó con un diseño completamente al alzar (DCA), en arreglo bifactorial para A. inconstans (dos aislamientos de entomonematodos vs. tres estados larvales de la plaga), planteando seis tratamientos más un testigo, sin NEP’s y un arreglo unifactorial para P. menetriesi (un aislamiento para los cinco estadíos), planteando cinco tratamientos más un testigo absoluto. Se compararon los datos para las dos especies con el aislamiento H. bacteriophora. La unidad experimental estaba compuesta por 12 larvas individualizadas. Las evaluaciones se realizaron a los 10 y 20 días después de la infección (DDI), registrando la variable mortalidad de las larvas. Los datos de mortalidad se corrigieron con la fórmula de Abbott (1925) y luego con 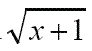 , previo al análisis de varianza y la separación de medias con la prueba de rangos múltiples de Tukey (P ≤ 0,05). Todo el análisis se realizó con el paquete estadístico INFOSTAT (2004).
, previo al análisis de varianza y la separación de medias con la prueba de rangos múltiples de Tukey (P ≤ 0,05). Todo el análisis se realizó con el paquete estadístico INFOSTAT (2004).
Resultados
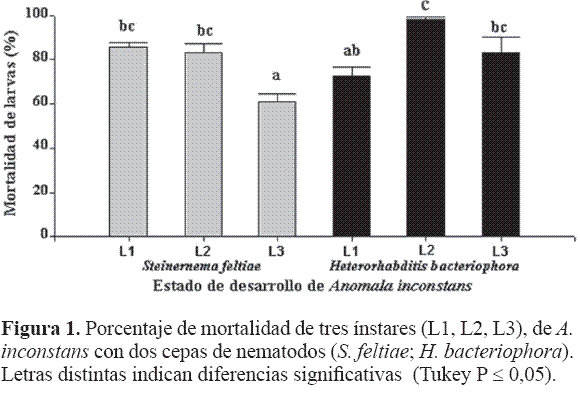
Al analizar la mortalidad de los estados de desarrollo de A. inconstans, el más susceptible fue larva 2 (L2) para H. bacteriophora (HNI); seguido por la L1 y L2 con S. feltiae (Sf) y L3 con HNI, pudiendo éstas presentar un comportamiento similar, en algún momento, al que ocurre con el estado más susceptible (L2), mientras que el menos afectado fue larva 3 (L3) para S. feltiae. Con el aislamiento S. feltiae la susceptibilidad de L1 y L2 fue similar mientras que L3 tuvo la menor mortalidad (Fig. 1). De los dos aislamientos HNI resultó más patogénico (F = 8,46 df = 2; P < 0,001), observándose mortalidades promedio de 84,7% (HNI) y 76,7% (S. feltiae); no se presentaron diferencias entre los tiempos de evaluación (10 y 20 DDI). Cuando se evaluó la mortalidad natural (Control) de estas larvas en los tres ínstares no se observaron diferencias y el promedio fue de 11%.
Por otra parte P. menetriesi, presentó mayor mortalidad a HNI en L2 (F = 39,68; df = 4; P < 0,001). Los estados de L1 y L3 joven presentaron mortalidades similares, seguidos por la L3 madura y prepupa; las cuales resultaron menos susceptibles al efecto de este NEP (Fig. 2); lo que podría explicarse porque L3 disminuye su alimentación y la prepupa no se alimenta, limitando así la principal vía de entrada de los NEP’s en las chisas (Jackson y Brooks 1995), estos resultados muestran una tendencia a disminuir la susceptibilidad a mayor estado de desarrollo.
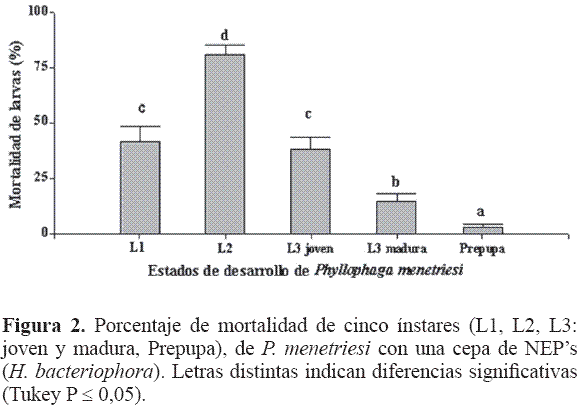
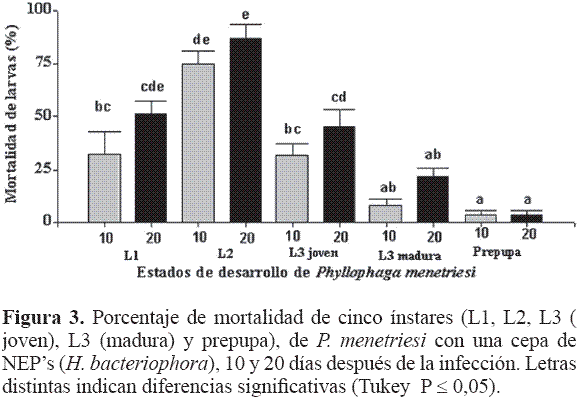
Cuando se comparó el tiempo de evaluación se obtuvieron diferencias (F = 7,71; df = 1; P = 0,009), resultando mayor mortalidad a los 20 DDI, lo que podría implicar que este nematodo necesita más tiempo para encontrar y matar a su presa (Fig. 3).
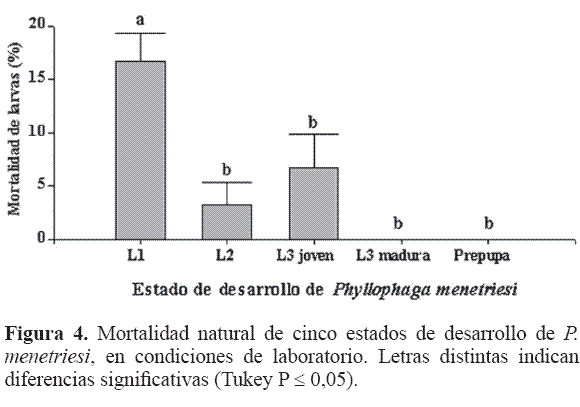
Al calcular la mortalidad natural en las condiciones del estudio (Fig. 4), la Larva 1 resultó ser más sensible, posiblemente debido a una mayor susceptibilidad de esta edad a las condiciones ambientales, comportamiento que podría ser compartido con L3 joven, de acuerdo con los resultados encontrados en el análisis; los otros ínstares presentaron mortalidades menores a nulas, siendo similares entre ellos (F = 10; df = 4; P < 0,003).
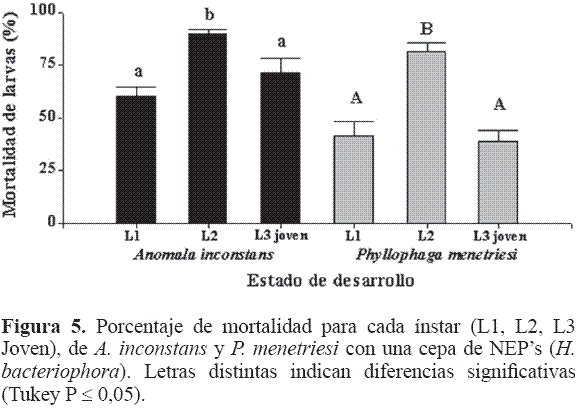
Cuando se compararon los tres estados (L1, L2 y L3 joven) de las dos especies de chisas frente a H. bacteriophora, se encontró que A. inconstans es más susceptible (73,8%) que P. menetriesi (53,8) (F = 20,3; df = 1; P < 0,001), lo que concuerda con previas experiencias donde P. menetriesi se mostró más resistente a estos entomopatógenos (CIAT 2004). En la Figura 5 se observa que para los dos rizófagos el estado que presentó mayor mortalidad fue Larva 2 (F = 21,65; df = 2; P < 0,001), diferenciándose a su vez de los otros estados (L1 y L3 joven), que comparten la misma mortalidad entre sí, ante las dos especies de chisas. En este caso la mortalidad en los dos tiempos de evaluación fue similar.
Discusión
En los resultados se encontró un claro efecto del estado de desarrollo de las chisas sobre la patogenicidad de los entomonematodos, este mismo efecto se observó en evaluaciones previas, donde se encontró un porcentaje de mortalidad muy bajo al controlar la L3 (10%) que además decrece al aumentar la madurez en este estado (CIAT 2004). Resultados similares obtuvieron Koppenhöffer y Fuzy (2004) al evaluar H. bacteriophora frente a Anomala orientalis Waterhouse, 1875 al controlar la L2, con mortalidades de 60% frente a los obtenidos con L3 (ca. 30%).
Se puede afirmar que el estado de desarrollo influye significativamente en la efectividad de los nematodos entomopatógenos, sin poder generalizar, ya que diferentes estudios muestran que esto depende de la especie de chisa y el nematodo; resultados con P. japonica con H. bacteriophora mostraron su mayor penetración en L3, mientras que A. orientalis mostró un aumento de la susceptibilidad de la L2 frente a L3, con la misma especie de nematodo (Wang y Gaugler 1998; Koppenhöffer y Fuzy 2004).
Adicionalmente, se ha observado una reducción en el control de insectos al aumentar de edad, este principio se ha demostrado tanto con insecticidas químicos como con agentes microbiológicos (Gaugler y Molloy 1981). En este aspecto el género Heterorhabditis posee una ventaja morfológica sobre Steinernema, por el diente terminal que posee, con el que raspa las áreas intersegmentales de la cutícula del insecto, facilitando la entrada por más partes del cuerpo (Ishibashi y Kondo 1990). Esta susceptibilidad asociada a la edad del hospedero también ha sido atribuida primariamente al tamaño de los orificios naturales que son punto de entrada de los NEP’s (espiráculos, ano y boca) (Jackson y Brooks 1995). Los mismos autores reportan que estados iniciales de Similium vittatum (Zetterstedt, 1838) (Diptera: Simuliidae), son menos susceptibles a nematodos entomopatógenos (58%) que los más desarrollados (97%). En otros estudios con Cyrtomenus bergi Froeschner, 1960 (Hemiptera: Cydnidae), ocurrió lo mismo, siendo el estado de adulto y el quinto más susceptibles que los primeros (Caicedo y Bellotti 1994; Barberena y Bellotti 1998; CIAT 2003).
En ensayos previos P. menetriesi ha demostrado ser una especie difícil de combatir, Shannon y Carballo (1996), mencionan que aislamientos de nematodos evaluados en otros insectos, inclusive en especímenes del mismo género (CIAT 2004), con los cuales se han obtenido excelentes resultados, no han funcionado para esta especie de chisa. De igual manera, Londoño (2001), evaluando el efecto de Steinernema sp. sobre este género, encontró mortalidades similares al testigo.
Diversas causas explicarían las diferencias en el grado de susceptibilidad entre los estados de desarrollo de las especies de chisas evaluadas; entre ellas se mencionan abajo diversas característica de tipo morfológico, fisiológico y hasta genético que estarían influyendo en su control; la variación interespecífica en los mecanismos de defensa; el tamaño y comportamiento del hospedero; el diámetro menor de los espiráculos en larvas jóvenes; las placas sobre estos que impiden la penetración del patógeno; la frecuente defecación, en la que se expulsa a los nematodos; comportamientos defensivos y evasivos de las larvas; una fuerte respuesta inmune asociada a la edad, donde estados más desarrollados pueden eliminar patógenos invasores, los estados iniciales juveniles que poseen una respuesta de anticuerpos más baja que en los maduros; la menor producción de CO2 y kairomonas en L1 y L2, lo que dificulta que los nematodos encuentren su hospedero y la cutícula en L3, la cual es difícil de penetrar por su grosor (Kaya 1985; Jackson y Brooks 1995; Koppenhöffer et al. 2004; Koppenhöffer y Fuzy 2004). Todos estos aspectos nos muestran algunas de las dificultades que tienen que vencer los entomopatógenos para poder controlar los diferentes estados de esta plaga, aspectos que no se pueden considerar constantes entre especies, y en los cuales se debería tratar cada caso en particular.
Teniendo en cuenta los resultados, se considera al segundo ínstar como el estado en el cual se debe ejercer el control de la chisa con estos entomopatógenos. Aspecto novedoso si se considera que en el país ninguna investigación previa a ésta ha mostrado el efecto en los diferentes estados de desarrollo de estas especies de chisa, lo cual nos permitirá redireccionar las investigaciones futuras, con el conocimiento sobre el momento de aparición del estado de desarrollo más susceptible. Queda todavía mucho por investigar respecto a factores ambientales y de formulación del bioproducto para manejarlo en campo, pero esto ya es un gran avance no solo para los NEP’s, sino, también para los otros potenciales microorganismos.
Literatura Citada
ABBOTT, W. S. 1925. A method of computing the effectiveness of an insecticide. Journal of Economic Entomology 18: 265-267. [ Links ]
ANDREWS, K. L. 1984. Proyecto Manejo Integrado de Plagas en Honduras: El manejo integrado de plagas invertebradas en cultivos agronómicos, hortícolas y frutales en la Escuela Agrícola Panamericana. Hoja Informativa 9. pp. 2-21. [ Links ]
ARAGÓN, A.; MORÓN, M. A.; LÓPEZ-OLGUÍN, CERVANTES-PEREDO, L. M. 2005. Ciclo De vida y conducta de adultos de cinco especies de Phyllophaga Harris, 1827 (Coleoptera: Melolonthidae; Melolonthinae). Acta Zoológica Mexicana 21 (2): 87-99. [ Links ]
AYALA, M. J. E.; MONTERROSO, L. E. 1998. Aspectos básicos sobre la biología de la gallina ciega. Manual Para Técnicos. Programa Regional de Reforzamiento a la Investigación Agronómica sobre los Granos en Centroamérica (PRIAG). 32 p. [ Links ]
BARBERENA, M. F.; BELLOTTI, A. C. 1998. Parasitismo de dos razas del nematodo Heterorhabditis bacteriophora sobre la chinche Cyrtomenus bergi (Hemiptera: Cydnidae) en laboratorio. Revista Colombiana de Entomología 24 (1-2): 7-11. [ Links ]
BELLOTTI, A. C.; REYES, J. A.; ARIAS, B. A.; VARGAS, O. 1983. Insectos y ácaros de la yuca y su control. pp. 69-93. En: Reyes, J. A. (ed.). Yuca: Control Integrado de Plagas. PNUD y Centro Internacional de Agricultura Tropical. 362 p. [ Links ]
CAICEDO, A. M.; BELLOTTI, A. C. 1994. Evaluación del potencial del nematodo entomógeno Steinernema carpocapsae Weiser (Rhabditida: Steinernematidae) para el control de Cyrtomenus bergi Froeschner (Hemiptera: Cydnidae) en condiciones de laboratorio. Revista Colombiana de Entomología 20 (4): 241-246. [ Links ]
CIAT. 2003. Cassava Entomology, pp. 1-42. En: Centro Internacional de Agricultura Tropical (CIAT). Annual Report. Integrate Pest and Disease Management in Major Agroecosystems. Cali, Colombia. 258 p. [ Links ]
CIAT. 2004. Soil pests-Cassava and other crops. p. 116-165. En: Centro Internacional de Agricultura Tropical (CIAT). Annual Report. Integrated Pest and Disease Management in Major Agroecosystems. Cali, Colombia. 417 p. [ Links ]
CIAT. 2005. Soil pests-Cassava and other crops. En: Centro Internacional de Agricultura Tropical (CIAT). Annual Report. Integrated Pest and Disease Management in Major Agroecosystems. Cali, Colombia. [ Links ]
FALCÓN, L. A.; SMITH, R. F. 1983. El concepto de control integrado de las plagas, pp. 15-20. En: Reyes A. (ed.). Yuca: Control Integrado de Plagas. PNUD y Centro Internacional de Agricultura Tropical. 362 p. [ Links ]
FORSCHLER, T. B.; GARDNER, A. W. 1991. Field efficacy and persistence of entomogenous nematodes in the management of white grubs (Coleoptera: Scarabaeidae) in turf and pastures. Journal of Economic Entomology 84 (5): 1454-1459. [ Links ]
GAUGLER, R.; MOLLOY, D. 1981. Instar susceptibility of Simulium vittatum (Diptera: Simuliidae) to the entomogenous nematodes Neoplectana carpocapsae. Journal of Nematology. 13 (1): 1-5. [ Links ]
HILJE, L. 1993. Abundancia estacional de adultos de Phyllophaga y Anomala (Coleoptera: Scarabaeidae) en Barva, Costa Rica, pp. 17-28. En: Morón, M. A. Diversidad y Manejo de plagas subterráneas. Publicación Especial de la Sociedad Mexicana de Entomología e Instituto de Ecología. Xalapa, Veracruz, México. 261 p. [ Links ]
INFOSTAT. 2004. Manual del usuario. Grupo INFOSTAT, FCA., Universidad Nacional de Córdoba. 1 Ed. Editorial Brujas Argentina. 318 p. [ Links ]
ICA. 1993a. Sección Investigación Básica Agrícola- Entomología. Abundante y dañina. Notas y Noticias Entomológicas (Colombia). Ene-Feb. pp. 10-11. [ Links ]
ICA. 1993b. Abundante y dañina. Notas y Noticias Entomológicas (Colombia). Mar-Abr. pp. 13-14. ISHIBASHI, N.; KONDO, E. 1990. Behavior of infective juveniles, pp. 139-150. En: Gaugler, R.; Kaya H. K. (eds.), Entomopathogenic nematodes in biological control. CRC. Press, Boca Raton, Florida. 365 p. [ Links ]
JACKSON, T. A. 1993. Developing microbial controls for scarab pest. En: Diversidad y Manejo de Plagas Subterráneas. Memorias de la IV Mesa Redonda sobre Plagas Subterráneas 14 y 15 de Octubre de 1993, Instituto de Ecología, AC. Xalapa, Veracruz, México. Sociedad Mexicana de Entomología, AC. Instituto de Ecología. AC. 261 p. [ Links ]
JACKSON, J. J.; BROOKS, M. A. 1995. Parasitism of Western Corn Rootworm larvae and pupae by Steinernema carpocapsae. Journal of Nematology 27 (1): 15-20. [ Links ]
KARD, B.; HAIN, F.; BROOKS, W. 1988. Field suppression of three white grubs species (Coleoptera: Scarabaeidae) by the entomogenous nematodes Steinernema feltiae and Heterorhabditis heliothidis. Journal of Economic Entomology 81 (4): 1033-1039. [ Links ]
KAYA, H. K. 1985. Susceptibility of early larval stages of Pseudalletia unipuncia and Spodoptera exigua (Lepidoptera: Noctuidae) to the entomogenous nematode Steinernema feltiae (Rhabditida: Steinernematidae). Journal of Invertebrate Pathology 46: 58-62. [ Links ]
KAYA, H. K. 1990. Soil ecology, pp. 93-115. En: Gaugler, R.; Kaya H. K. (eds.). Entomopathogenic nematodes in biological control. CRC. Press, Boca Raton, Florida. 365 p. [ Links ]
KING, B. S. 1984. Biology and Identification of white grubs (Phyllophaga) of economic importance in Central America. Tropical Pest Management 30 (1): 36-50. [ Links ]
KING, B. S.; SAUNDERS, J. L. 1984. Las plagas invertebradas de cultivos anuales alimenticios en América Central. Overseas Development Administration, Londres. 182 p. [ Links ]
KLEIN , M. G .1981 .Advances in the use of Bacillus for pests control , pp. 183-192 . En: Burges , H. D . (ed.). Microbial Control Pests and plant diseases 970-1980. Academic Press. New York . 949 p . [ Links ]
KLEIN, M. G. 1990. Efficacy against soil-inhabiting insects pest, pp. 93-115. En: Gaugler, R.; Kaya H. K. (eds.). Entomopathogenic nematodes in biological control. CRC. Press, Boca Raton, Florida. 365 p. [ Links ]
KOPPENHÖFFER, A. M.; FUZY, E. M. 2004. Effect of white grub developmental stage on susceptibility to entomopathogenic nematodes. Journal of Economic Entomology 97 (6): 1842-1849. [ Links ]
KOPPENHÖFFER, A. M.; FUZY, E. M.; CROCKER, R. L.; GELERNTER, W. D.; POLAVAPARU, S. 2004. Pathogenicity of Heterorhabditis bacteriophora, Steinernema glaseri, and S. scarabaei (Rhabditida: Heterorhabditidae, Steinernematidae) against 12 white grubs species (Coleoptera: Scarabaeidae). Biocontrol Science and Technology 14 (1): 87-92. [ Links ]
LONDOÑO, M. E. 2001. Las chisas y su manejo, hortalizas, plagas y enfermedades. Corpoica-Sociedad Colombiana de Entomología. pp. 36-47. Rionegro. 26 Revista Colombiana de Entomología [ Links ]
MADRIGAL, A. C. 2002. Plagas forestales de las regiones cálidas colombianas. En: Memorias. XXIX Congreso de la Sociedad Colombiana de Entomología. pp. 66-80. Montería. MARION, L. P. 1941. Insects pests of faro, garden and orchad. John Wiley sons. New York. 549 p. [ Links ]
MELO, E. L.; GAIGL, A. 2004. Experiencias con el uso de nematodos entomopatógenos en el manejo de dos plagas subterráneas del trópico central de Colombia. En: Memorias. XXXI Congreso de la Sociedad Colombiana de Entomología. pp. 203-206. Bogotá. [ Links ]
MORÓN, M. A. 1995. La diversidad de coleópteros Scarabaeoide o Lamellicornia en Colombia y su repercusión en el complejo plagas subterráneas. Memorias, II Reunión Latinoamericana de Scarabaeidología. Pontificia Universidad Javeriana. pp. 1-3. Bogotá. [ Links ]
PARDO-LOCARNO, L. C. 1993. Estudio preliminar de las especies Melolonthidae del Valle del Cauca Colombia con énfasis en la cuenca Calima-San Juan (Valle-Chocó). En: Diversidad y Manejo de plagas subterráneas. Publicación Especial de la Sociedad Mexicana de Entomología e Instituto de Ecología. Xalapa, Veracruz, México. pp. 83-90. [ Links ]
PARDO-LOCARNO, L. C. 2000. Avances en el estudio de chisas rizófagas (Coleoptera: Melolonthidae) en Colombia, observaciones sobre los complejos regionales y nuevos patrones morfológicos de larvas. En: III curso nacional sobre taxonomía de escarabajos de importancia económica en Colombia. 53 p. Palmira. [ Links ]
PARDO-LOCARNO, L. C. 2002. Aspectos sistemáticos y bioecológicos del complejo chisa (Col, Melolonthidae) de Caldono, Norte del Cauca, Colombia. Trabajo de grado de Maestría en Biología. Universidad del Valle, Facultad de Ciencias, Santiago de Cali. 145 p. [ Links ]
PARDO-LOCARNO, L. C.; FRANCO, M. P.; ALARCON, A. A. 1995. Estudios preliminares de las chisas (Coleoptera: Lamellicornia) de San Antonio, Cauca. Registros y observaciones en Laparosticti y Pleurosticti. Revista Colombiana de Entomología 21 (1): 51-57. [ Links ]
POSADA, F. J. 1989. Lista de insectos dañinos y otras plagas en Colombia. Instituto Colombiano Agropecuario, (Boletín Técnico 43). Bogotá. 662 p. [ Links ]
POSADA, O. L. 1993. Las chisas, sus enemigos naturales y recomendaciones sobre su manejo. Agricultura Tropical 30 (3): 71-79. [ Links ]
PRIOR, C. 1992. Pathogens of scarabaeid pests of sugar cane in Mauritius and Reunion and potential control strategies, pp. 237-246. En: Jackson, T. A.; Glare, T. R (eds.). Use of pathogens in scarab pest management. Intercept. Andover. [ Links ]
QUINTERO, M. P. 2003. Comparación en laboratorio de la patogenicidad de tres especies de nematodos entomopatógenos (Rhabditida) sobre larvas de tercer instar de Phyllophaga menetriesi (Blanchard) (Coleoptera: Scarabaeidae). Trabajo de grado de Biología. Universidad del Valle, Facultad de Ciencias. Santiago de Cali. 49 p. [ Links ]
RAMÍREZ-SALINAS, C.; CASTRO, A. E.; MORÓN, M. A. 2001. Descripción de la larva y pupa de Euphoria basalis (Gory y Percheron, 1833) (Coleoptera: Melolonthidae: Cetoniinae) con observaciones sobre su biología. Acta Zoológica Mexicana (nueva serie) 83: 73-82. [ Links ]
RITCHER, P.O. 1958. Biology of Scarabaeidae. Annual Review of Entomology 3: 311-335. [ Links ]
ROBERTSON, L. N.; ALLSOPP, P. G.; ROGERS, D. J. 1970. Management of soil insects after 40 years in the Wilderness: High Technology or working with nature?. Soil Invertebrates in 1997. Bureau of Sugar Experiment Stations, Brisbane. pp. 1-7. [ Links ]
RODRÍGUEZ, M.; FRANCE, A.; GERDING, M. 2004. Evaluación de dos cepas del hongo Metarhizium anisopliae var. anisopliae (Metsh.) para el control de larvas de gusano blanco Hylamorpha elegans Burn. (Coleoptera: Sacarabaeidae). Agricultura Técnica 64 (1): 1-11. [ Links ]
SÁNCHEZ, G.; VÁSQUEZ, N. C. 1996. Manejo de plagas en arracacha. Boletín de Investigación, Corpoica, 43 p. Ibagué. [ Links ]
SHANNON, P. J. 1994. Control microbiano de Phyllophaga spp. (Col: Melolonthidae). En: Memoria. Seminario-Taller sobre la Biología y Control de Phyllophaga spp. Informe Técnico 277. CATIE. Turrialba, Costa Rica. pp. 80-92 [ Links ]
SHANNON, P.; CARBALLO, M. 1996. Biología y control de Phyllophaga spp. Seminario-Taller Centroamericano sobre la biología y control de Phyllophaga spp. CATIE, Turrialba, Costa Rica. CATIE. Serie Técnica. Informe Técnico 227. pp. 80-93 [ Links ]
VALLEJO, F. 1997. Contribución al conocimiento de las plagas subterráneas-chisas (Coleoptera: Melolonthidae) del oriente de Antioquia. Trabajo de grado de Maestría en Entomología. Facultad de Ciencias, Universidad Nacional de Colombia. Medellín. 236 p. [ Links ]
VILLANI, M. G.; WRIGHT, R. J. 1988. Entomogenous nematodes as biological control agents of european chafer an japanese beetle (Coleoptera: Scarabaeidae) larvae infesting turftgrass. Journal of Economic Entomology 81 (2): 484- 487. [ Links ]
WANG, Y.; GAUGLER, R. 1998. Host and penetration site location by entomopathogenic nematodes against Japanese beetle larvae. Journal of Invertebrate Pathology 66: 178- 184. [ Links ]
WRIGHT, R. J.; VILLANI, M. G.; AGUDELO-SILVA, F. 1988. Steinernematid and Heterorhabditid nematodes for control of larval european chafers and japanese beetles (Coleoptera: Scarabaeidae) in potted yew. Journal of Economic Entomology 81 (1): 152-157. [ Links ]
Recibido: 12-ene-2006 - Aceptado: 01-abr-2007